Badania i bolączki terapii genowej
1990 r. - pierwsze zatwierdzone badanie terapii genowej. Komórki układu odpornościowego pobrane od czteroletniej Ashanti DeSilvy zostają wzbogacone o właściwą wersję genu deaminazy adenozynowej w celu leczenia u dziewczynki ciężkiego złożonego niedoboru odporności (SCID). Terapia ta jest skuteczna, ale tylko przez jakiś czas.
1992 r. - skuteczne leczenie SCID/ADA poprzez terapię genową opartą na komórkach macierzystych pobranych ze szpiku kostnego.
1999 r. - osiemnastoletni Jesse Gelsinger umiera w wyniku reakcji układu odpornościowego wirusy użyte do wprowadzenia właściwego genu do jego genomu. Amerykańska Agencja Żywności i Leków wstrzymuje kilka badań do czasu ich ponownej oceny pod względem moralnym i proceduralnym.
2000 r. - ogłoszenie, że dwóch chłopców z Francji z ciężkim złożonym niedoborem odporności sprzężonym z chromosomem X jest leczonych za pomocą terapii genowej.
2002 r. - zawieszenie francuskiego badania terapii genowej SCID po tym, jak u czworga dzieci w wyniku zastosowania retrowirusowego nośnika DNA rozwija się białaczka.
2003 r. - chińska firma Shenzhen SiBiono GeneTech uzyskuje zgodę na leczenie nowotworów głowy i szyi preparatem Gendicine - zmodyfikowanym adenowirusem przenoszącym gen supresorowy.
2003 r. - amerykańscy naukowcy rozpoczynają pierwsze badanie na ludziach z wykorzystaniem zmodyfikowanego lentiwirusa. Jest to nieaktywny wirus HIV przenoszący gen hamujący replikację. Badanie okazuje się sukcesem. 2009 r. - ośmioletni Corey Haas, który cierpi na rzadką dziedziczną chorobę oczu i prawie nie widzi, zyskuje normalny wzrok dzięki terapii genowej mającej na celu wymianę białka pigmentu siatkówki.
2009 r. - dzięki terapii genowej u dwóch chłopców powstrzymany zostaje postęp degeneracyjnej adrenoleukodystrofii.
2010 r. - dorosły ze schorzeniem krwi o nazwie talasemia beta przestaje potrzebować comiesięcznych transfuzji po terapii genowej polegającej na wprowadzeniu właściwego genu beta-globiny do jego komórek macierzystych tworzących krew.
2011 r. - sześcioro pacjentów z zaburzeniami krzepnięcia krwi o nazwie hemofilia B doświadcza redukcji objawów choroby po zastosowaniu terapii genowej z wykorzystaniem komórek wątroby.
2012 r. - Glybera staje się pierwszym stosowanym w terapii genowej lekiem zatwierdzonym w Europie. Jest dopuszczony do stosowania w leczeniu niedoboru lipazy lipoproteinowej.
2013 r. - dwa artykuły opisują leczenie dzieci z zaburzeniem degeneracyjnym zwanym leukodystrofią metachromatyczną oraz chorobą układu odpornościowego o nazwie zespół Wiskotta-Aldricha z wykorzystaniem terapii genowej ("Science", doi.org/pnv, doi.org/ppk).
Styczeń 2014 r. - ogłoszenie dotyczące pięciorga skutecznie leczonych dzieci z zaburzeniem SCID/ADA, które są w dobrym stanie.
Przekonanie, że geny to nasz spadek po przodkach, z którym trzeba żyć, bez względu, jak ciężkie jest to życie, powoli odchodzi w niepamięć. Medycyna wciąż szuka rozwiązań, by zapobiegać chorobom, do których przyczyniają się nieszczęśliwe mutacje genetyczne. Jednym z nich jest terapia genowa. Polega ona na zastąpieniu wadliwego genu, prawidłowym. Jednak powiedzieć jest prościej niż zrobić. Dlatego naukowcy zaprzęgli do tej niewdzięcznej roboty wirusy.
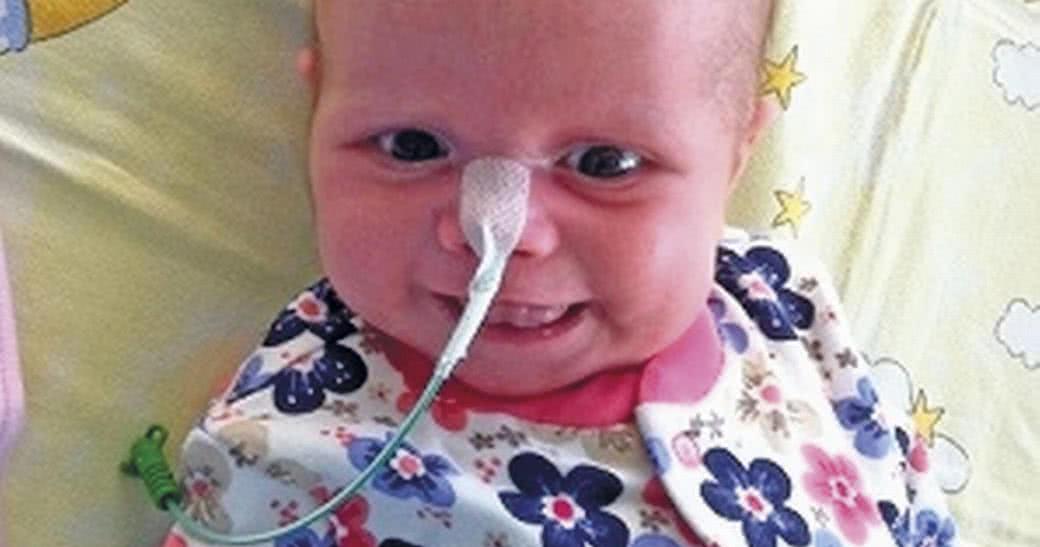
Gdy pięciotygodniowa Nina przesypiała spokojnie całe noce i nie odczuwała wcale głodu, jej mama Aga Warnell wiedziała, że coś jest nie w porządku. Zachowanie najmłodszej córki bardzo różniło się od jej starszych sióstr.
W ciągu następnych tygodni Nina bardzo ciężko zachorowała. Najpierw zdiagnozowano u niej rotawirusa, a zaraz potem u dziewczynki rozwinęło się zapalenie płuc.
Jak podaje New Scientist: "Okazało się, że Nina cierpiała na chorobę zwaną ciężkim złożonym niedoborem odporności (ang. severe combined immunodeficiency, SCID). W wyniku wady genetycznej urodziła się bez układu immunologicznego. Jako że ludzie dotknięci tą przypadłością muszą żyć w sterylnym otoczeniu, jest ona również znana jako choroba chłopca z bańki. - Lekarze powiedzieli, że musimy przygotować się na to, że Nina prawdopodobnie nie przeżyje - mówił Graeme, ojciec Niny.
Od tamtej pory minęło półtora roku. Nina jest teraz szczęśliwą małą dziewczynką z funkcjonującym układem odpornościowym. Zawdzięcza to terapii genowej oraz jej najnowszym ulepszeniom."
Wszystko zaczęło się w 1912 r. gdy pewien włoski ginekolog zaobserwował remisję raka szyjki macicy u kobiety, którą wcześniej zaszczepiono przeciw wściekliźnie. Kolejne lata przynosiły informacje wskazujące na to, że obecność wirusów w organizmie ludzkim, może hamować lub wręcz powodować cofnięcie się niektórych schorzeń. Naukowcy postanowili stworzyć zmodyfikowanego genetycznie wirusa, tak by przenosił odpowiedni gen do właściwych komórek.
Pierwsze próby uleczenia SCID za pomocą tej metody zaczęły się ponad dwadzieścia lat temu. Jednak dwa lata po jej zastosowaniu u czworga młodych pacjentów zdiagnozowano białaczkę.
We wrześniu 1999 r. w cztery dni po wstrzyknięciu wirusów do wątroby, gdzie miały naprawić dziedziczną chorobę - deficyt transkarbamylazy ornitynowej, zmarł osiemnastoletni Jesse Gelsinger. Przyczyną jego śmierci był ostry zespół zaburzeń oddechowych i niewydolność wielu narządów. Jak podejrzewali lekarze, była to ostra reakcja immunologiczna na dużą dawkę adenowirusów. Był to początek wyboistej drogi (patrz "Badania i bolączki terapii genowej").
Od tamtego czasu terapia genowa przeszła długą drogę, a przypadki Niny i innych osób stanowią jej punkty zwrotne. Badacze wciąż starają się ulepszać swoje "wynalazki", tak by w jak najbezpieczniejszy sposób móc sterować naszymi genami.
W styczniu br. na konferencji Europejskiego Towarzystwa Terapii Genowej i Komórkowej w Madrycie w Hiszpanii zaprezentowano wstępne wyniki dotyczące dwójki pierwszych dzieci poddanych 18 miesięcy temu ulepszonej terapii genowej SCID.
Bobby Gaspar z Great Ormond Street Hospital w Londynie, który prowadził eksperyment, zapewnia, że od momentu wdrożenia leczenia funkcjonowanie układów odpornościowych pacjentów wciąż się poprawia.
Jak donoszą New Scientist i Science: "Od tamtego czasu terapię genową zastosowano u trojga kolejnych dzieci, m.in. u Niny. Również ci pacjenci dają oznaki pełnego powrotu do zdrowia."
Ogół ciężkiej pracy prowadzi do punktu, w którym terapia genowa może stać się medycyną rutynową
Cała wspomniana wyżej piątka leczonych dzieci cierpiała na rodzaj zaburzenia zwanego SCID/ADA powodowanego przez wadliwy gen deaminazy adenozynowej. Zazwyczaj enzym ten usuwa cząsteczki toksyn z białych krwinek. W przypadku jego braku przybywa szkodliwych substancji, które zabijają komórki zwalczające infekcje.
W kwietniu 2012 r. ze szpiku kostnego Niny pobrano komórki macierzyste, uzupełniono je o właściwą wersję genu deaminazy adenozynowej, a następnie ponownie wprowadzono do jej organizmu. Nie oczekiwano znaczącego polepszenia jej stanu wcześniej niż w grudniu. Jednak do sierpnia liczba jej białych krwinek prawie się podwoiła, a dziś Nina ma układ odpornościowy zdrowego noworodka.
- Sukcesy w końcu zaczynają przewyższać porażki. Lata ciężkiej pracy prowadzą do punktu, w którym terapia genowa może stać się bardziej rutynowo stosowaną procedurą medyczną - mówi Inder Verma z Salk Institute w La Jolla w Kalifornii."
Koncepcja terapii genowej
Jak już pisaliśmy koncepcja terapii genowej jest prosta - do organizmu osoby z wadliwym genem wprowadza się jego właściwą wersję, czego efektem powinno być przezwyciężenie defektu. W praktyce jest to jednak bardziej skomplikowane, bo nie wystarczy wnieść gen do komórki, trzeba jeszcze sprawić, by przyłączył się do DNA pacjenta i skłonić komórki chorego do odczytywania prawidłowej wersji. Konieczne jest zatem zastosowanie nośnika DNA.
Wirusy przenoszą się z miejsca na miejsce mając ze sobą jedynie swój materiał genetyczny ciasno upakowany wewnątrz kapsydu (białkowa otoczka). Przyczepiają się do komórek, umieszczają w nich własne geny i wykorzystują ich procesy życiowe do skopiowania oraz syntezy swoich białek. W ten sposób wykorzystując energię ofiary namnażają się. Nowe wirusy pobierają fragmenty błony komórkowej, w których dalej podróżują po zarażonym organizmie. Każda rodzina wirusów bardzo dokładnie wybiera miejsce dokowania - szuka odpowiednich receptorów na powierzchni komórki. Z tego powodu niektóre powodują kłopoty z wątrobą a inne przeziębienie.
To sprawiło, że wybór badaczy poszukujących właściwego nośnika DNA padł na wirusy. Teraz trzeba było zdecydować, które z nich będą najskuteczniejsze. Początkowo stawiano na retrowirusy, które na stałe wbudowują leczniczy gen do komórek zarażonej osoby. Jednak czas i kolejne badania pokazały, że retrowirusy wprowadzają geny w przypadkowe lokalizacje genomu oraz wpisują weń sekwencje regulatorowe, które mogą czasem aktywizować pobliskie geny i powodować nowotwory.
Liczba jej białych krwinek podwoiła się, a dziś Nina ma układ odpornościowy normalnego noworodka.
Aby przezwyciężyć tę przeszkodę, naukowcy zwrócili się w stronę lentiwirusów, które również wprowadzają geny do genomu w sposób losowy, można je jednak tak modyfikować, by blokowały niektóre sekwencje regulatorowe.
- Chociaż nowa generacja lentiwirusowych nośników DNA jest o wiele bezpieczniejsza, ryzyko wciąż istnieje. Jednakże nie stosuje się terapii genowej przy bólu zęba, tylko próbuje leczyć dzięki niej choroby prowadzące do przedwczesnej śmierci - mówił New Scientist Patrick Aubourg z francuskiego Państwowego Instytutu Zdrowia i Badań Medycznych w Paryżu.
Wcześniej za pomocą zmodyfikowanego lentiwirusa skutecznie leczono troje dzieci z degeneracyjnymi zaburzeniami enzymu oraz troje z chorobą układu immunologicznego zwaną zespołem Wiskotta-Aldricha. Obiecujące wyniki obserwuje się również w przypadku degeneracyjnego schorzenia o nazwie adrenoleukodystrofia oraz talasemii beta, czyli choroby krwinek. Obecnie trwa około 700 badań terapii genowych, w których wykorzystuje się lentiwirusy.
Inne nośniki DNA również zapowiadają się obiecująco. Na przykład wirus związany z adenowirusem (AAV) nie wprowadza własnych genów do genomu pacjenta, tylko umieszcza je wzdłuż niego, co oznacza, że są odczytywane, ale nieprzekazywane do kolejnych generacji komórek. Stanowi to problem, tylko jeśli grupą docelową są stosunkowo krótko żyjące komórki, np. układu odpornościowego. Gdy chce się modyfikować neurony bądź komórki wątroby, które mogą przetrwać całe dziesięciolecia, nie jest to kłopotliwe.
Na wspomnianej już konferencji w Madrycie Amit Nathwani z Royal Free NHS Trust w Londynie ogłosił, że organizmy sześciorga pacjentów z hemofilią leczonych z wykorzystaniem AAV na początku 2011 r. wciąż produkują czynnik krzepnięcia krwi, którego im wcześniej brakowało.
Jak mówi Maria Limberis z Uniwersytetu Pensylwanii w Filadelfii, na tej samej zasadzie można by leczyć inne choroby, w przypadku których konieczne jest uzyskanie wydzielania jakiegoś białka lub enzymu do krwi.
Stan zdrowia Niny wciąż się polepsza, a jej rodzina uwalnia się od izolacji, na którą zdecydowała się, żeby wspomóc ochronę dziewczynki. Graeme przyznaje, że decyzja o wzięciu udziału w badaniu nie była łatwa.
- Pomyśleliśmy jednak, że jeśli możemy wyleczyć Ninę poprzez zrobienie czegoś, co rozwinie praktykę medyczną i być może pomoże innym dzieciom, to jest to kierunek, który powinniśmy obrać - wyznał New Scientist.

 Nasze magazyny
Nasze magazyny