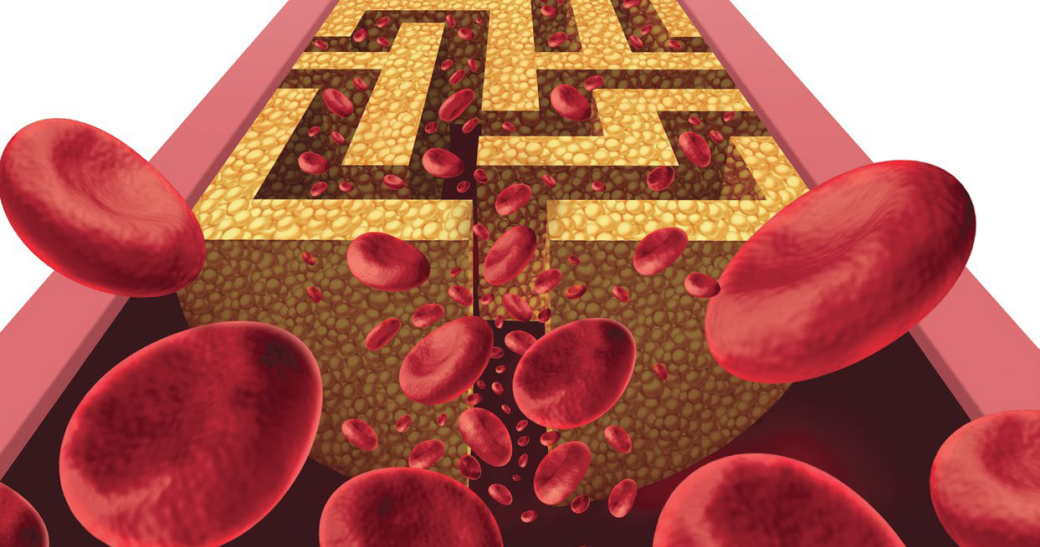
Choć odkryto ją w 1932 r., przez lata nie cieszyła się nadmiernym zainteresowaniem naukowców. Dopiero później okazało się, że wysoki poziom homocysteiny (Hcy) w organizmie czyni komórki nabłonka naczyń krwionośnych bardziej podatnymi na uszkodzenia.
Homocysteina powoduje pogrubienie i zwężenie tętnic, zarówno tych wieńcowych, jak i mózgowych. Białko to uszkadza również naczynia poprzez potencjalne osłabianie dopływu tlenu i substancji odżywczych do mózgu. Coraz częściej uważa się je nawet za wiarygodny marker biochemiczny o znaczeniu prognostycznym i diagnostycznym dla różnorakich zagrożeń organizmu, zalecając rutynowe oznaczania poziomu tego aminokwasu we krwi.
Co to jest homocysteina?
Homocysteina to białko powstające we wnętrzu wszystkich komórek organizmu z metioniny pochodzącej ze spożywanego białka. Później zostaje z nich uwolnione do osocza, gdzie krąży głównie w postaci utlenionej. W większości (ok. 80%) homocysteina jest związana z innymi białkami, pozostałe 20% występuje jako homocystyna lub disiarczki z innymi tiolami, np. cysteiną1.
Nawet niewielki nadmiar homocysteiny jest niezależnym czynnikiem ryzyka chorób układu krążenia.
Później ulega przemianom metabolicznym do cysteiny lub przekształceniu z powrotem do metioniny w procesie remetylacji. W tym pierwszym przypadku istotną rolę odgrywa odpowiedni poziom witaminy B6 jako kofaktora. Z kolei do remetylacji niezbędna jest obecność witaminy B12 i kwasu foliowego jako koenzymów.
Jeśli homocysteina nie zostanie przekształcona w cysteinę lub metioninę, zacznie gromadzić się nadmiernie we krwi, gdzie staje się szkodliwa – jej podwyższone stężenie jest jednym z ważniejszych czynników ryzyka miażdżycy i chorób zakrzepowo-zatorowych.
Jakie są konsekwencje nadmiaru homocysteiny we krwi?
Znaczenie nadmiaru homocysteiny jako czynnika ryzyka w patogenezie miażdżycy jest intensywnie badane w ostatnich latach, ale dane na ten temat pojawiły się w końcu lat 60. XX w. W 1969 r. McCully jako pierwszy zauważył istnienie przyczynowego związku między podwyższonym stężeniem aminokwasu a występowaniem procesów zakrzepowo-zatorowych i wysunął homocysteinową teorię miażdżycy2.
Związek ten został udowodniony u pacjentów z homocystynurią (genetycznie uwarunkowaną chorobą polegającą na nieprawidłowym metabolizmie metioniny), która powoduje bardzo wysokie stężenia homocysteiny we krwi, ciężką miażdżycę oraz zwiększone ryzyko tętniczych i żylnych procesów zakrzepowo-zatorowych już w młodym wieku3.
Później stwierdzono, że u pacjentów z chorobą niedokrwienną serca częściej niż u zdrowych osób występują podwyższone poziomy tego białka we krwi. Dalsze obserwacje epidemiologiczne potwierdzały, że hiperhomocysteinemia i nawet niewielki wzrost stężenia Hcy są istotnymi czynnikami ryzyka miażdżycy tętnic. Na podstawie 5-letniej obserwacji u prawie 15 tys. lekarzy wykazano, że mężczyźni, u których poziomy te przekraczały o 12% górny zakres normy, byli 3 razy bardziej zagrożeni zawałem mięśnia sercowego4.
Na podstawie analizy wyników 27 wieloośrodkowych badań stwierdzono, że homocysteina jest niezależnym czynnikiem ryzyka chorób układu krążenia, a wzrost stężenia Hcy o 5 µmol/l zwiększa zagrożenie nimi 1,6-1,8 razy5. Nie oznacza to jednak, że należy rozpatrywać ją w oderwaniu od innych czynników ryzyka – współistnienie hiperhomocysteinemii zwłaszcza z nadciśnieniem tętniczym potęguje promiażdżycowe działanie, przy czym ten niekorzystny wpływ nadmiaru homocysteiny jest większy u kobiet niż u mężczyzn6.
Stosując badania ultrasonograficzne, naukowcy odkryli również, że istnieje ścisła korelacja między nasileniem zmian miażdżycowych w tętnicach szyjnych, wieńcowych i obwodowych a poziomem homocysteiny w surowicy7.
Wysoki poziom homocysteiny zwiększa ryzyko chorób serca
Metaanaliza obejmująca 30 badań obserwacyjnych z lat 1966-1999 wykazała, że nadmiar aminokwasu jest czynnikiem przepowiadającym wystąpienie zawału serca lub udaru mózgu. Stwierdzono, że wzrost stężenia homocysteiny o 1 µmol/l wiąże się ze wzrostem ryzyka choroby niedokrwiennej o 3-4%, a udaru o ok. 6%8.
Równocześnie wykazano, że niższym o 25% stężeniom homocysteiny towarzyszyło mniejsze ryzyko występowania choroby niedokrwiennej serca (o 11-16%), udaru (o 19-22%) i procesów zakrzepowych żył głębokich (o 25%). Jednocześnie wyższe stężenia homocysteiny wiązały się z częstszą hospitalizacją z powodu schorzeń sercowo-naczyniowych, ale tylko w najstarszej grupie analizowanych chorych9.
Stwierdzono, że wśród ludzi cierpiących z powodu choroby niedokrwiennej ryzyko sercowo-naczyniowe wzrasta znacząco, jeśli stężenie Hcy sięga powyżej 10 µmol/l. Kiedy zaś przekracza 15 µmol/l, względne ryzyko sercowo-naczyniowe rośnie do 1,4 w stosunku do grupy chorych z poziomami poniżej 10 µmol/l10.
Z kolei 77 przekrojowych badań przeprowadzonych wśród ponad 34 tys. osób oraz 33 badania prospektywne z udziałem ponad 12 tys. uczestników wykazały związki między zaburzeniami funkcji poznawczych a homocysteiną i/lub witaminami z grupy B. Udowodniono, że zbyt duża jej ilość we krwi (powyżej 10 µmol/l) jest czynnikiem ryzyka rozwoju demencji i alzheimera11.
Choć najważniejszy wydaje się wpływ homocysteiny na procesy miażdżycowe, jej poziom może sprzyjać również rozwojowi innych schorzeń. Wyniki wielu badań wskazują przykładowo na związek między podwyższonym stężeniem homocysteiny oraz niedoborem kwasu foliowego a występowaniem powikłań w przebiegu ciąży.
Wysokie stężenie tego aminokwasu w płynie pęcherzykowym jajnika może zaburzać interakcję między plemnikiem a komórką jajową, zmniejszając szanse zapłodnienia, a także wpływać na wczesne etapy implantacji i embriogenezy oraz upośledzać ukrwienie łożyska i jego funkcje. Wczesnym skutkiem tych zaburzeń jest poronienie, natomiast późniejszym – zahamowanie rozwoju płodu, jego obumarcie, a także przedwczesne oddzielenie łożyska.
Podwyższony poziom homocysteiny podczas ciąży stanowi czynnik ryzyka wystąpienia wad cewy nerwowej. W stanach niedoboru kwasu foliowego aminokwas ten gromadzi się w komórkach zarodka, powodując liczne uszkodzenia. Wykazano również, że wywiera bezpośredni efekt teratogenny12. Nadmiar homocysteiny jest też czynnikiem ryzyka powstawania raka, szczególnie jelita grubego oraz nowotworów indukowanych przez estrogeny13.
Jak to działa?
Homocysteina w fizjologicznych stężeniach nie wywiera szkodliwego wpływu – dopiero jej nadmiar działa aterogennie (promiażdżycowo). Molekularne mechanizmy tej aktywności nie zostały jeszcze całkowicie poznane, ale dużą rolę przypisuje się aspektom wolnorodnikowym. Z badań in vitro wiadomo, że homocysteina pobudza wytwarzanie wolnych rodników tlenowych, a także sama ulega w osoczu autooksydacji, której towarzyszy ich wytworzenie.
Związki te zmieniają różne struktury, w tym śródbłonek naczyń, w którym powodują wolnorodnikowe uszkodzenia, a szczególnie peroksydację lipidów błon komórkowych. Wolne rodniki tlenowe utleniają też osoczowe lipoproteiny LDL, co zwiększa ich aterogenność14.
Co więcej, w badaniach na zwierzęcych komórkach śródbłonka naczyń wykazano, że nadmiar homocysteiny nie tylko nasila tworzenie wolnych rodników tlenowych, ale także obniża zdolność komórek do rozkładu tych toksycznych związków poprzez hamowanie aktywności peroksydazy glutationowej (GSH-Px), podstawowego enzymu antyoksydacyjnego15.
Ponadto homocysteina nagromadzona we krwi uszkadza ścianę tętnic, zapoczątkowując proces zapalny i rozwój zmian miażdżycowych. Inny prawdopodobny mechanizm polega na bezpośrednim toksycznym działaniu na śródbłonek naczyń, a także hamowaniu uwalniania tlenku azotu lub na zmniejszaniu jego dostępności biologicznej, co upośledza jego działanie wazodylatacyjne (rozkurczowe). Potwierdzeniem tego jest stwierdzenie dwukrotnie mniejszego rozszerzenia naczyń wywołanego przekrwieniem w grupie osób z hiperhomocysteinemią16.
Nadmiar homocysteiny pobudza też proliferację mięśni gładkich tętnic i gromadzenie kolagenu w ścianach naczyń. I wreszcie homocysteina wpływa niekorzystnie na układ krzepnięcia.
Wysoki poziom homocysteiny jest niebezpieczny dla mózgu
Wszystkie te mechanizmy stanowią zagrożenie przede wszystkim dla układu sercowego, ale również ośrodkowego układu nerwowego (OUN). Zaburzenia krążenia mózgowego prowadzą bowiem do obumierania neuronów i dysfunkcji neuroprzekaźnictwa. U pacjentów z otępieniem, mających powyżej 80 lat, stwierdzono mikroangiopatie oraz objawy niedokrwiennego uszkodzenia mózgu17.
Homocysteina bierze udział w wydzielaniu peptydów β-amyloidowych (Aβ), które są głównym składnikiem płytek starczych. Ich szkodliwe działanie polega na aktywacji apoptozy i procesów neurotoksycznych. Metabolity homocysteiny zwiększają aktywację glutaminowych receptorów typu N-metylo-D-asparaginianu (NMDA), co powoduje wzrost stężenia jonów wapnia i uwalnianie proteaz, a następnie utratę łączności między komórkami nerwowymi oraz ich obumieranie.
Przyczyny podwyższonego stężenia homocysteiny
Pozostaje jeszcze odpowiedzieć na jedno ważne pytanie: jak to się dzieje, że stężenie homocysteiny wzrasta do niebezpiecznego poziomu? Do przyczyn takiego stanu rzeczy należą genetycznie uwarunkowane zaburzenia jej metabolizmu, nadmiar w diecie białka zawierającego metioninę, niedobory witamin niezbędnych w procesach jej przemian, czynniki demograficzne oraz niektóre choroby.
Stężenie homocysteiny istotnie wzrasta w przebiegu nefropatii i niewydolności nerek, nowotworów, leukemii, łuszczycy, schorzeń autoimmunologicznych, cukrzycy i niedoczynności tarczycy18. Jest również większe u mężczyzn, ale u obu płci wzrasta z wiekiem (u kobiet zwłaszcza po menopauzie, co wiąże się ze spadkiem poziomu estrogenów).
Mechanizm tego wzrostu nie zawsze jest znany, ale może on wynikać z niedoborów witamin lub zaburzenia aktywności enzymów biorących udział w przemianach biochemicznych homocysteiny. Z kolei niektóre leki wpływają na zaburzenia wchłaniania kwasu foliowego, witaminy B12 i pirydoksyny (forma B6). Również nadmierne spożywanie alkoholu i kawy oraz palenie tytoniu zaburzają prawidłowe wchłanianie kwasu foliowego19. W dymie papierosowym znajduje się dodatkowo wiele substancji toksycznych, z których tlenek węgla i disiarczek węgla hamują aktywność witaminy B6 w wątrobie, zmniejszając metabolizm homocysteiny.
Właśnie niedobory lub złe wchłanianie witamin, które są kofaktorami enzymów w procesach przemian metabolicznych homocysteiny, to najczęstszy powód wzrostu jej ilości w organizmie. W badaniach stwierdzono odwrotną korelację między poziomem tego aminokwasu a stężeniem kwasu foliowego, witamin B12 i B6. Aż u 95% osób z niedoborami kwasu foliowego i witaminy B12 występuje hiperhomocysteinemia20!
Badania osób ze stwierdzonymi zmianami miażdżycowymi w tętnicach i stężeniem homocysteiny we krwi wyższym niż 14 µmol/l wykazały korzystny wpływ leczenia witaminami B12, B6 i kwasem foliowym. Zaobserwowano u nich spadek poziomu aminokwasu, a proces tworzenia blaszek miażdżycowych uległ zahamowaniu21.
Dlatego też zarówno w profilaktyce, jak i leczeniu hiperhomocysteinemii zalecana jest dieta bogata w te składniki. Najwięcej folianów zawierają drożdże piekarskie, jednak głównym źródłem są warzywa zielone, takie jak: szpinak, sałata, brokuły, brukselka, szparagi, kalafior i pietruszka. Witaminy B12 dostarczają produkty pochodzenia zwierzęcego, głównie podroby, a także ryby, jaja i produkty mleczne. Natomiast B6 należy szukać przede wszystkim w mięsie, rybach, nasionach roślin strączkowych, ziarnach zbóż oraz papryce, brukselce, kapuście, szpinaku, marchwi i bananach.
Jaka jest norma na homocysteinę?
Prawidłowe wartości homocysteiny we krwi mierzone na czczo mieszczą się w zakresie 5-15 μmol/l. Wykazano jednak, że już stężenia rzędu 10- 13 μmol/l wywierają szkodliwy wpływ na śródbłonek naczyń. Dlatego też w świetle rekomendacji ekspertów zakres referencyjny stężeń powinien być ustalany osobno dla poszczególnych populacji z uwzględnieniem wieku (poziom homocysteiny wzrasta z upływem czasu), płci (po okresie dojrzewania stężenie aminokwasu jest wyższe u mężczyzn o ok. 2 μmol/l), ciąży, czynników etnicznych, rodzaju diety, stylu życia i występujących schorzeń1.
Niemniej kiedy całkowite stężenie w osoczu krwi jest wyższe niż 15 μmol/l, mówi się o hiperhomocysteinemii. Badania pokazują, że w Polsce może to dotyczyć aż 17% dorosłych2.
- Adv Clin Exp Med 2006; 15(5):897-903
- Am. J. Pathol. 1969; 56:111-128
- Clin. Chem., 2004; 50:3-32
- JAMA 1992; 268:877-881
- JAMA 1995; 274:1049-1057
- JAMA 1997; 277:1775-1781
- J.Intern. Med. 1999; 246:425-454
- JAMA, 2002; 28:2015-2023
- Arch. Int. Med. 2002; 162:1374-1381
- Circulation 1999; 99:178-182; Circulation, 1998; 97:437-443
- Arch Gerontol Geriatr, 2009; 48: 425-30; Food Nutr Bull, 2008; 29 [2 Suppl]: S143-72; N Engl J Med. 2002 Feb 14, 476-83
- Adv Clin Exp Med 2006; 15(5):897-903; Biul Wydz Farm AMW 2005; 3:4-13
- Farm Współ 2008; 1:169-175
- Pol. Arch. Med. Wew., 1997; 98:153-162
- J. Biol. Chem., 1997; 272(27):17012-17017
- Proc. Natl. Acad. Sci. USA, 1994; 91:6369-6373; J. Biol. Chem. 1997; 272(27):17012-17017
- Czyn Ryzyka 2005; supl. 11:20-22
- Cancer Res., 1991; 51: 828-835; J. Am. Diet. Assoc., 2006; 106: 267-270
- Clin. Chem., 2004; 50: 3-32
- Am. J. Clin. Nutr., 2001; 73: 1027-1033
- Postepy Hig Med Dosw. 2004; 58: 381-389
- Co to jest homocysteina?
- Jakie są konsekwencje nadmiaru homocysteiny we krwi?
- Wysoki poziom homocysteiny zwiększa ryzyko chorób serca
- Wysoki poziom homocysteiny w ciąży
- Wysoki poziom homocysteiny jest niebezpieczny dla mózgu
- Przyczyny podwyższonego stężenia homocysteiny
- Jaka jest norma na homocysteinę?

 Nasze magazyny
Nasze magazyny