Alergia pokarmowa (ang. food allergy, FA) jest nieprawidłową odpowiedzią układu odpornościowego, występującą w sposób powtarzalny, po ekspozycji na dany pokarm. Należy ją odróżnić od nietolerancji pokarmowej, która jest reakcją nieimmunologiczną, obejmującą metaboliczne, toksyczne, farmakologiczne i niezdefiniowane mechanizmy.
Obecnie FA stanowi poważny problem zdrowotny. Częstość jej występowania znacznie wzrosła w ciągu ostatnich 20 lat na całym świecie, szczególnie w krajach rozwiniętych. Odsetek przypadków w ogólnej populacje szacuje się na 5% u dorosłych i 8% u dzieci. Niniejszy przegląd ma na celu przedstawienie aktualnego stanu wiedzy na temat przyczyn, diagnostyki, profilaktyki i leczenia alergii pokarmowej u dzieci.
Skąd biorą się alergie pokarmowe?
Istnieje kilka możliwych hipotez co do przyczyn powstawania alergii pokarmowych. Wśród nich warto wymienić te dotyczące higieny, podwójnego alergenu, witaminy D, mikrobioty i „fałszywego alarmu”.
- Hipoteza higieny sugeruje, że brak ekspozycji na drobnoustroje i infekcje we wczesnym dzieciństwie może zwiększać podatność na choroby alergiczne poprzez wpływ na rozwój układu odpornościowego. Wiąże się to z przewagą odpowiedzi immunologicznej limfocytów Th2 zamiast Th1. Badania obserwacyjne sugerują, że ekspozycja na drobnoustroje i potencjalne alergeny, w tym kontakt ze zwierzętami domowymi, opieka nad dziećmi, poród tzw. siłami natury i obecność starszego rodzeństwa, mogą chronić przed rozwojem alergii pokarmowej.
- Hipoteza podwójnego alergenu zakłada, że zaburzona funkcja bariery skórnej w wyprysku niemowlęcym może powodować uczulenie na alergeny. Zgodnie z tą hipotezą, do ekspozycji dochodzi przez skórę, a nie drogą doustną. Ponadto zdaje się, że kontakt z antygenami pokarmowymi przez skórę z większym prawdopodobieństwem doprowadzi do alergii, w porównaniu do wczesnego spożycia tego alergenu, które częściej prowadzi do tolerancji. FA jest zatem prawdopodobnie połączeniem ekspozycji skóry i jelit na antygen pokarmowy, z większą tendencją do uczulenia, jeśli pierwszy kontakt odbył się przez skórę.
- Hipoteza witaminy D sugeruje niedobór tego składnika jako możliwy czynnik ryzyka rozwoju alergii pokarmowej. Witaminę D po raz pierwszy powiązano z zapobieganiem FA poprzez wykazanie, że niemowlęta z jej poziomem poniżej 50 nmol/L (800 j.m.) w wieku 1 roku miały 11-krotnie wyższe ryzyko alergii na orzeszki ziemne, potwierdzone doustną próbą prowokacyjną, w porównaniu do niemowląt z wyższym poziomem tej witaminy. Niektóre badania sugerują także, że cholekalcyferol (aktywna forma witaminy D) odgrywa ważną rolę w regulacji różnicowania i pobudzaniu różnych typów limfocytów T. Wykazano przy tym, że odpowiedź immunologiczna niektórych z nich ma pierwszeństwo w warunkach niskiego poziomu lub niedoboru witaminy D.

- Hipoteza mikrobioty zakłada, że obecność określonych szczepów bakterii w jelitach, a także składników diety i ich metabolitów, może wpływać na rozwój alergii pokarmowej.
- Hipoteza fałszywego alarmu. Niedawno specjaliści zaproponowali także inną teorię, która mogłaby wyjaśnić wzrost przypadków FA. Zachodnia dieta jest bogata w zaawansowane produkty glikacji (AGE), pochodzące z gotowanego mięsa, oleju i sera oraz wysokiego stężenia cukru. Sugerują oni, że AGE, które są obecne lub powstają z żywności, uruchamiają szlaki, prowadzące do rozwoju alergii pokarmowej.
Prezentacja kliniczna
Alergia pokarmowa nie jest pojedynczym schorzeniem, ani nie wywołuje jej pojedyncze zaburzenie patofizjologiczne. Rodzaj i nasilenie objawów mają różne natężenie u pacjentów, a u tej samej osoby zmieniają się od jednej reakcji do drugiej, w zależności od spożytego pokarmu – a przy tym samym pokarmie, w zależności od ekspozycji na uczulającą cząsteczkę.
Zarówno w przypadku IgE-zależnej, jak i IgE-niezależnej alergii pokarmowej, objawy najczęściej dotyczą skóry, przewodu pokarmowego, układu oddechowego i układu sercowo-naczyniowego. Krótki okres (zwykle poniżej 2 godzin) między spożyciem pokarmu a pojawieniem się objawów prowadzi do podejrzenia reakcji IgE-zależnej, z wyjątkiem anafilaksji wysiłkowej, zależnej od pokarmu (FDEIA) i opóźnionej anafilaksji na czerwone mięso.
Na przykład alergia na mleko krowie (CMA) wyzwala różne mechanizmy immunologiczne, które wywołują odmienne objawy kliniczne. W przypadku CMA, w której pośredniczy immunoglobulina E, symptomy są często charakterystyczne i powtarzalne. Pojawiają się w ciągu dwóch godzin od pierwszej ekspozycji na mleko krowie i obejmują objawy skórne (zaczerwienienie, pokrzywka, obrzęk naczynioruchowy, świąd itp.) bądź też objawy żołądkowo-jelitowe (w tym nudności, wymioty, a niekiedy biegunka), a czasami również inne symptomy, takie jak płacz lub letarg itp.

Jak wygląda diagnozowanie alergii pokarmowej?
Rozpoznanie alergii pokarmowej nie jest proste ze względu na jej liczne objawy oraz fakt, że testy diagnostyczne nie zawsze wystarczą, aby mieć pewność co do przyczyny symptomów. Połączenie wywiadu i testów w niektórych przypadkach może zapewnić wystarczającą wiarygodność, aby postawić diagnozę alergii pokarmowej bez przeprowadzania doustnej prowokacji pokarmowej (OFC). We wszystkich innych przypadkach lub jeśli wymagana jest pewność diagnozy, zleca się OFC.
Rozpoznanie IgE-zależnej FA opiera się na zgodnym wywiadzie klinicznym i wynikach skórnych testów punktowych lub oznaczeniu swoistych immunoglobulin E w surowicy. Dokładne zebranie wywiadu klinicznego jest niezbędne do określenia, kiedy potrzeba dalszych badań diagnostycznych, jak je wdrożyć i zinterpretować ich wyniki.
Wywiad kliniczny ma na celu rozpoznanie przypadków alergii pokarmowej poprzez zbadanie objawów, możliwych alergenów, zależności między spożyciem danego składnika a wystąpieniem objawów, spożytej dawki, współistniejących chorób, potencjalnych czynników sprzyjających uczuleniu lub reakcji krzyżowych, innych alergii, roli podejrzewanego alergenu w diecie i możliwych skutków poprzednich diet. Celem wywiadu jest również identyfikacja możliwego mechanizmu immunologicznego, leżącego u podstaw FA.
Niektóre stany mogą wskazywać na reakcje za pośrednictwem immunoglobuliny E, takie jak objawy ze strony skóry (pokrzywka, obrzęk naczynioruchowy, wysypka rumieniowa), układu oddechowego (zapalenie spojówek nosa, kaszel, duszność lub astma) lub przewodu pokarmowego (świąd jamy ustnej, nudności, wymioty, ból brzucha i biegunka), a nawet złe samopoczucie i obniżenie ciśnienia krwi, które występują w ciągu 2 godzin po spożyciu prawdopodobnego alergenu.
Anafilaksja wysiłkowa zależna od pokarmu (FDEIA) jest wyjątkiem, ponieważ pojawia się z większym opóźnieniem. Najdłuższe odstępy między jedzeniem a wystąpieniem objawów wynosiły 3,5 godziny, podczas gdy między rozpoczęciem ćwiczeń a manifestacją objawów wynosiły 50 minut. Osoby dotknięte FDEIA są uczulone na pokarm odpowiedzialny za anafilaksję, nawet jeśli poziomy swoistych IgE we krwi są niższe niż w przypadku innych alergii pokarmowych.
Spożycie podejrzanego składnika wywołuje objawy kliniczne tylko wtedy, gdy następuje po nim wysiłek fizyczny. Jednocześnie aktywność fizyczna nie wywołuje niepożądanych reakcji, jeśli nie jest poprzedzona spożyciem pokarmu.
W alergenowo-swoistej FDEIA rola wysiłku fizycznego (lub innych czynników sprzyjających, takich jak aspiryna, alkohol itp.) jest kluczowa, ponieważ powoduje wystąpienie reakcji na pokarm, który jest powszechnie spożywany przez pacjenta, bez żadnych objawów klinicznych. Opóźnione symptomy, zwłaszcza te dotyczące przewodu pokarmowego, prowadzą jednak do reakcji, w której nie pośredniczy IgE lub do reakcji mieszanej.
Oba testy mają dobrą czułość, ale niską swoistość, co oznacza, że często są dodatnie u osób niealergicznych. Kilku specjalistów, wytyczne i międzynarodowy konsensus zasugerowały stawianie diagnozy FA bez wykonywania doustnej prowokacji pokarmowej. Komitet Alergii Pokarmowej Włoskiego Towarzystwa Alergii i Immunologii Dziecięcej (SIAIP) opublikował niedawno dwa przeglądy systematyczne, dotyczące wartości skórnych testów punktowych i swoistych IgE dla jaj i mleka.
Te wartości zależą od częstości występowania w populacji oraz od innych zmiennych, takich jak historia zdrowotna, wiek, płeć, położenie geograficzne, pochodzenie etniczne i współistniejące alergie na dany alergen pokarmowy, stopień gotowania żywności używanej do doustnej prowokacji pokarmowej, rodzaj alergenu użytego do wykonania skórnego testu punktowego (np. ekstrakt handlowy lub surowa żywność) itp. Nie jest zatem możliwe łatwe zastosowanie tych wytycznych w różnych populacjach i w różnych warunkach.
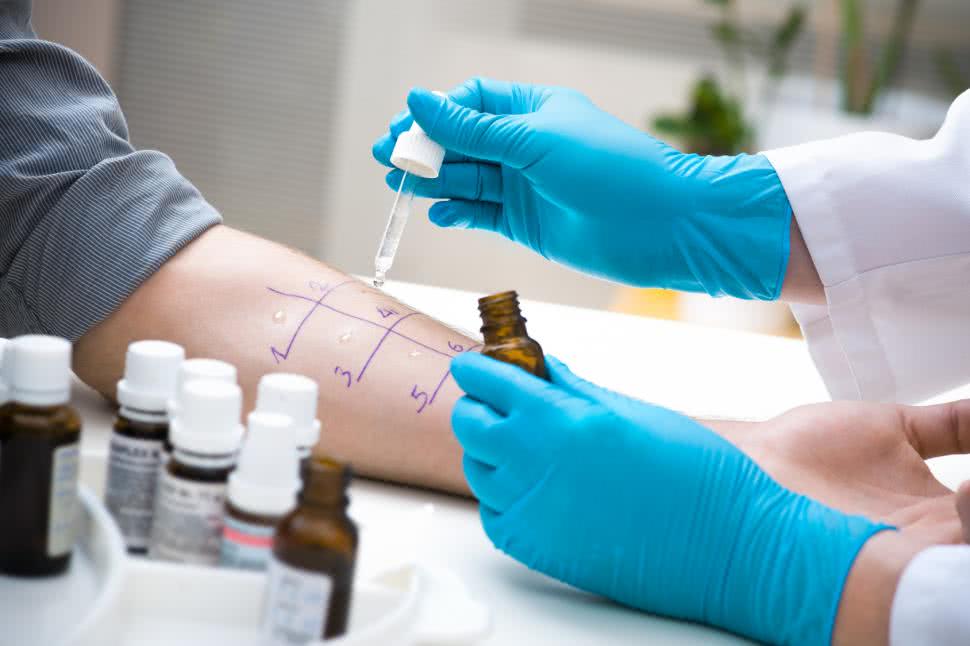
Nowe podejście diagnostyczne
Testy diagnostyczne z komponentami alergenowymi (CRD) to metoda umożliwiająca dozowanie oczyszczonych lub rekombinowanych alergenów w celu rozpoznania określonych cząsteczek, powodujących uczulenie lub alergię kliniczną.
CRD może być wykonywany w formatach pojedynczego testu lub w mikromacierzy (specjalnym czipie laboratoryjnym), testując jednocześnie zakres ponad 100 oczyszczonych alergenów. Do tej pory scharakteryzowano znaczną liczbę cząsteczek alergennych zawartych w żywności, a ich liczba stale rośnie. Jednak tylko niektóre z nich mogą być wykorzystywane do przeprowadzania testów in vitro.
Niedawno opracowano inne testy, zdolne do wykrywania alergii na ponad 200 ekstraktów i cząsteczek jednocześnie. W opublikowanym jakiś czas temu przewodniku, dotyczącym alergologii molekularnej, zaproponowano, że diagnostyka molekularna może poprawić całkowite testy alergenów IgE, gdy występuje niska obfitość bądź niestabilność białek pokarmowych w konwencjonalnych testach alergicznych, gdy dostarcza ona informacji o cząsteczkach związanych z ryzykiem lub nasileniem alergii oraz gdy przekazuje informacje nt. wskaźników reaktywności krzyżowej związanej z żywnością lub markerów prawdziwego uczulenia.
Inne wskazania do stosowania CRD obejmują anafilaksję idiopatyczną, opóźnioną anafilaksję na czerwone mięso, anafilaksję wysiłkową zależną od pszenicy, rozróżnienie między cząsteczkami wysokiego i niskiego ryzyka z pokarmów wywołujących anafilaksję pokarmową (orzeszki ziemne, orzechy, krewetki itp.), alergię na pieczone jajko lub mleko (owomukoid, kazeina) itp.
Test ten jest natomiast mało przydatny, gdy istnieje przekonująca historia alergii IgE-zależnej i dodatni wynik punktowych testów skórnych lub swoistych IgE na odpowiedni alergen pokarmowy; te informacje są już wystarczające do postawienia diagnozy. Jednak CRD ma pewne ograniczenia w codziennej praktyce.
- Po pierwsze, tylko niektóre cząsteczki alergenów są dostępne na rynku. Na przykład niemożliwe jest dozowanie jednego z białek brzoskwini. Dlatego, jeśli sam CRD miałby być użyty do poszukiwania specyficznych brzoskwiniowych IgE, mogłyby pojawić się fałszywie ujemne wyniki. Co więcej, nie ma możliwości oznaczenia IgE dla alergennych cząsteczek niektórych pokarmów, takich jak morela, orzeszki piniowe itp.
- Po drugie, rodzina cząsteczek alergennych sugeruje nasilenie potencjalnej reakcji; jednak nie przewiduje jej z całą pewnością. Na przykład, pozytywny wynik dla jednego z alergenów wiąże się z łagodnymi reakcjami, jednak uczulenie na inny, należący do tej samej rodziny białek, może wywołać poważne reakcje.
- Po trzecie, pozytywny wynik testu na obecność alergenów nie oznacza określonej reakcji klinicznej. Podobnie jak w przypadku punktowego testu skórnego, wyższe wartości IgE dla niektórych pokarmów wiążą się z większym prawdopodobieństwem wystąpienia reakcji alergicznej podczas wykonywania doustnej prowokacji.
- Wreszcie, metody diagnostyczne mogą po prostu dawać różne wyniki. Pojedynczy test zapewnia wyniki ilościowe i wydaje się być precyzyjniejszy w odniesieniu do metod multipleksowych. Ta ostatnia zapewnia półilościowe wyniki, które mogą być sprzeczne w zależności od zastosowanej metodologii.
Testy aktywacji bazofilów (BAT) znalazły zastosowanie w diagnostyce alergii na mleko krowie, jaja i orzeszki ziemne, wykazując wyższą swoistość i większą ujemną wartość predykcyjną niż punktowe testy skórne i na swoiste IgE. Jednak nie są one dostępne we wszystkich placówkach.
Zapobieganie alergiom pokarmowym
Oprócz przyczyn genetycznych, na które wskazuje historia chorób alergicznych w rodzinie, wykazano, że kilka czynników środowiskowych wpływa na rozwój chorób alergicznych. Mogą one działać przede wszystkim w czasie ciąży (dym tytoniowy, zanieczyszczenie środowiska, niezrównoważona dieta itp.), w okresie okołoporodowym (poród przez cesarskie cięcie, pro – i prebiotyki itp.) oraz w okresie poporodowym.
Wśród tych czynników jest m.in. mikrobiota jelitowa, infekcje, karmienie mlekiem modyfikowanym, wiek wprowadzenia pokarmów stałych itp. Spośród nich ostatni zawsze miał kluczowe znaczenie. W minionych latach uważano, że opóźnienie wprowadzania pokarmów może zapobiec rozwojowi alergii pokarmowych.
Późniejsze badania wykazały, że takie podejście nie było skuteczne, a wręcz mogło stać się przyczyną zwiększonej częstości występowania FA. Badania wykazały, że wskaźnik alergii na orzeszki ziemne jest wyższy w krajach, w których unikano ekspozycji na nie w okresie ciąży i niemowlęctwa.
Kilka badań wykazało związek między wypryskiem atopowym w dzieciństwie a rozwojem alergii pokarmowych, zwłaszcza na jajka, orzeszki ziemne i mleko krowie. Opierając się na tych obserwacjach, niektórzy specjaliści zaproponowali hipotezę podwójnej ekspozycji na alergeny dla patogenezy FA, jak opisano powyżej.
Z tego powodu do chwili obecnej przeprowadzono szereg badań interwencyjnych w celu sprawdzenia, czy wczesne wprowadzenie pokarmów stałych do diety byłoby w stanie ograniczyć rozwój alergii pokarmowych. Pierwsze badanie wykazało, że u dzieci z grupy wysokiego ryzyka (ciężkie atopowe zapalenie skóry wraz z alergią na jajko lub sama alergia, a także pozytywny test skórny na orzeszki ziemne), wprowadzenie gotowanego jajka w wieku 4-6 miesięcy wiąże się z niższym ryzykiem alergii w porównaniu z wprowadzeniem go w wieku 10-12 miesięcy i później.
Kolejne badanie, EAT, przeprowadzone na populacji ogólnej, oceniło wpływ wczesnego wprowadzenia (3 miesiące życia) orzeszków ziemnych i innych 5 pokarmów (mleko, jaja, sezam, pszenica i ryby). Badanie wykazało brak redukcji alergii pokarmowych w grupie z zamiarem leczenia.
Wykazano ochronną korzyść wczesnego przestawiania na pokarmy stałe jedynie przed rozwojem alergii na orzeszki ziemne i jaja. Jednak bardzo niska zgodność z interwencją (poniżej 40%) wskazywała na trudności z odstawieniem od piersi trzymiesięcznych niemowląt. W rezultacie opublikowano specjalny dodatek dotyczący zapobiegania alergii na orzeszki ziemne w Stanach Zjednoczonych.

W dokumencie tym przedstawiono wytyczne dotyczące czasu wprowadzenia fistaszków, dzieląc populację dzieci według ryzyka rozwoju alergii. W sumie 6 badań dotyczyło skuteczności wczesnego wprowadzania jaj. Różnią się one zarówno pod względem udziału w nich populacji ogólnej lub osób zagrożonych rozwojem choroby alergicznej, jak i wykorzystania gotowanego lub surowego jajka.
W dwóch badaniach, PETIT i EAT, zastosowano podgrzewane białko. Badanie PETIT wykazało znaczące korzyści z wczesnego wprowadzenia jajka bez znaczących obaw o bezpieczeństwo w populacji wysokiego ryzyka. Drugie badanie, jak wspomniano powyżej, wykazało redukcję alergii pokarmowej tylko w analizie wyników końcowych.
W czterech innych badaniach (STAR, STEP, BEAT i HEAP) wykorzystano surowe jajko. Dwa z nich, STAR i BEAT, dały niejednoznaczne wyniki. Pozostałe dwa nie wykazały znaczącego zmniejszenia alergii na jajka. Z drugiej strony, badania te wykazały, że odsetek od 3,9% do 30% dzieci rozwinął reakcję alergiczną podczas pierwszego kontaktu z jajkiem.
Biorąc pod uwagę te wyniki, różne towarzystwa naukowe zasugerowały kilka rozbieżnych zaleceń. Te z Ameryki Północnej nie poparły wczesnego wprowadzania produktów jajecznych. Według Europejskiego Towarzystwa Gastroenterologii i Hepatologii Dziecięcej (ESPGHAN) potencjalnie alergizujące pokarmy mogą być wprowadzane, gdy karmienie uzupełniające rozpoczyna się w dowolnym momencie po 4 miesiącach, zarówno u niemowląt karmionych piersią, jak i mlekiem modyfikowanym oraz niezależnie od ryzyka atopii.
Brytyjskie Towarzystwo Alergii i Immunologii Klinicznej (BSACI) sugeruje wczesne wprowadzenie (od 4. miesiąca życia) gotowanego jajka tylko u dzieci z wysokim ryzykiem alergii, ostrzegając przed potencjalnymi reakcjami alergicznymi.
Włoskie Towarzystwo Alergii i Immunologii Dziecięcej (SIAIP) sugeruje dokonanie u niemowląt z grupy wysokiego ryzyka oceny poziomu przeciwciał IgE swoistych dla całego jaja w surowicy lub wykonanie skórnych testów punktowych na obecność jaja przed pierwszym podaniem.
Jeśli wynik testu skórnego lub specyficznych przeciwciał IgE jest ujemny, gotowane jajko można wprowadzić w niewielkiej ilości po rozpoczęciu karmienia uzupełniającego. Jeśli wynik testu skórnego lub IgE jest dodatni, jajko należy wprowadzać w specjalistycznych warunkach z natychmiastową pomocą w nagłych wypadkach i pod nadzorem alergologa z doświadczeniem w tej dziedzinie. Jeśli chodzi o wczesne wprowadzanie innych pokarmów, aktualna literatura nie wydaje się sugerować żadnych korzyści.
Wreszcie, ponieważ atopowe zapalenie skóry uważa się za czynnik ryzyka alergii pokarmowych ze względu na upośledzoną funkcję bariery i stan zapalny skóry, kilka badań miało na celu ocenę, czy agresywna terapia zapalenia skóry może zmniejszyć rozwój AZS i alergii pokarmowych. Niektóre wstępne prace zdawały się sugerować skuteczność stosowania emolientów w zapobieganiu zarówno atopowemu zapaleniu skóry, jak i uczuleniom alergicznym.
W związku z tym zaprojektowano i rozpoczęto dwa duże badania profilaktyczne: PreventADALL i BEEP. Nieoczekiwanie wyniki tych badań nie potwierdzają skuteczności stosowania tych interwencji w zapobieganiu AZS.
Badanie PreventADALL wykazało, że ani regularne stosowanie emolientów na skórę od 2 tygodnia życia, ani wczesne karmienie uzupełniające wprowadzone między 12 a 16 tygodniem życia nie mogą zmniejszyć rozwoju atopowego zapalenia skóry do 12 miesiąca życia u 2397 niemowląt z populacji ogólnej.
W badaniu BEEP 1394 noworodkom urodzonym o czasie, u których w rodzinie występowała choroba atopowa, losowo przydzielono stosowanie emolientu codziennie przez pierwszy rok oraz udzielono standardowych porad dotyczących pielęgnacji skóry (grupa emolientowa) lub tylko zastosowano standardowe porady dotyczące pielęgnacji skóry (grupa kontrolna). Interwencja nie zapobiegła rozwojowi wyprysku w wieku 24 miesięcy, który wystąpił u 23% osób z grupy leczonej i 25% osób z grupy kontrolnej.
Co więcej, wtórny wynik alergii pokarmowej wydawał się częstszy w grupie leczonej (7%) niż w grupie kontrolnej (5%). W dyskusji autor badania sugeruje, że bardziej wyrafinowana formuła emolientu może potencjalnie mieć działanie ochronne. W związku z tym w celu potwierdzenia tej hipotezy przygotowano duże randomizowane badanie kontrolowane u niemowląt z grupy wysokiego ryzyka, zwane w skrócie PEBBLES.
Jak poradzić sobie z alergią pokarmową?
Podstawowe leczenie alergii pokarmowych obejmuje ścisłe unikanie wywołującej je żywności oraz szybką identyfikację oraz leczenie anafilaksji. Unikanie pokarmów to podstawa zapobiegania reakcjom pokarmowym w długoterminowym leczeniu IgE-zależnych i IgE-niezależnych FA.
Pacjentów i ich rodziny należy poinstruować w zakresie unikania pokarmów, podkreślając znaczenie ścisłego przestrzegania podanych wskazań dietetycznych (wraz ze szczególną ostrożnością w kontakcie krzyżowym), bezpiecznym ich przechowywaniu, procedurze czyszczenia, a także ostrożności w stosunku do pojedynczych składników i całej żywności.
Ostrożne opisywanie alergenów na produktach wskazujące na niskie ilości potencjalnych źródeł uczulenia nie jest regulowane w większości krajów, w tym w UE.

Rozproszone i sprzeczne użycie tych wyrażeń spowodowało niedocenianie tego ostrzeżenia, ignorowanego nawet przez 40% pacjentów. Unikanie wybranych pokarmów może mieć szkodliwy wpływ na spożycie składników odżywczych, powodując niedobory żywieniowe, dlatego zaleca się konsultacje żywieniowe i monitorowanie wzrostu u dzieci i pacjentów z pojedynczymi lub mnogimi alergiami pokarmowymi.
FA ma wpływ na jakość życia dotkniętych nią dzieci i nastolatków, a także ich rodzin i opiekunów. Co więcej, unikanie konkretnych pokarmów często wiąże się z wysiłkiem ekonomicznym gospodarstwa domowego.
Farmakoterapia
Leczenie alergii pokarmowej zależy od nasilenia reakcji i objawów. Leki przeciwhistaminowe, takie jak difenhydramina i cetyryzyna podaje się powszechnie w przypadku łagodnych reakcji wywołanych pokarmem, takich jak obrzęk naczynioruchowy lub pokrzywka. Podobnie jak leki przeciwhistaminowe, glikokortykoidy (np. prednizon czy metyloprednizolon) powinny być stosowane jako terapia wspomagająca w przypadku objawów skórnych, śluzowych lub oddechowych, szczególnie u pacjentów z astmą.
Oba leki mogą być przydatne w zmniejszaniu objawów, ale nie zatrzymują postępu reakcji alergicznej, nie ratują życia ani nie odgrywają roli pomocniczej w leczeniu anafilaksji. Mają opóźniony początek działania i pomimo niewielu dowodów potwierdzających ich rolę w anafilaksji, są one powszechnie stosowane w tej sytuacji.
Identyfikacja reakcji anafilaktycznej jest pierwszym istotnym krokiem w leczeniu. Nagłe wystąpienie i niejednorodny obraz kliniczny są typowe dla anafilaksji. Epinefryna (adrenalina) wstrzyknięta domięśniowo w środkową część uda jest leczeniem z wyboru w przypadku anafilaksji.
Dzięki działaniu zwężającemu naczynia krwionośne epinefryna zapobiega lub zmniejsza obrzęk błony śluzowej górnych dróg oddechowych, niedociśnienie i wstrząs. Ma również ważne działanie rozszerzające oskrzela i wpływa na pracę serca.
Szybkie leczenie adrenaliną może spowolnić lub zatrzymać postęp ciężkiej anafilaksji. Taka reakcja występuje głównie w warunkach niemedycznych, dlatego użycie automatycznego wstrzykiwacza epinefryny jest niezbędne do szybkiego leczenia i powinno być przepisywane wszystkim pacjentom, którzy doświadczyli anafilaksji lub tym, którzy są nią zagrożeni.
Odczulanie na żywność
Jeśli chodzi o bezpieczeństwo, pewna metaanaliza wykazała, że zarówno reakcje ogólnoustrojowe, jak i miejscowe, były częstsze u dzieci otrzymujących doustną immunoterapię (OIT) niż u dzieci otrzymujących leczenie kontrolne.
W związku z tym późniejsze wytyczne EAACI dotyczące immunoterapii alergenowej zawierają zalecenia odnośnie bezpieczeństwa, w tym uważne monitorowanie pacjentów pod kątem reakcji alergicznych, zwłaszcza podczas fazy zwiększania dawki doustnej, oraz monitorowanie objawów nowo powstałego eozynofilowego zapalenia przełyku.
Ponadto przed rozpoczęciem tej formy odczulania zaleca się dokładne wyjaśnienie zarówno ryzyka wystąpienia reakcji, jak i szczegółową ocenę czynników ryzyka wystąpienia zdarzeń niepożądanych.
Przegląd systematyczny i metaanaliza 12 badań z udziałem ponad 1000 pacjentów poddanych doustnej immunoterapii w przypadku orzeszków ziemnych wykazały, że w porównaniu z unikaniem alergenów lub placebo, OIT zwiększała reakcje alergiczne, anafilaksję i stosowanie epinefryny. Tak więc, takie odczulanie jest skuteczną praktyką w alergiach pokarmowych, w której pośredniczą immunoglobuliny E. Należy wdrożyć podejścia zwiększające bezpieczeństwo.
Wnioski
Diagnostyka i leczenie alergii pokarmowych pozostają wyzwaniem pomimo poprawy i większej dostępności nowo opracowanego sprzętu diagnostycznego i terapeutycznego. W przyszłości konieczne będą dalsze badania nad opracowaniem strategii zapobiegania, a także bezpiecznych i skutecznych terapii, które zapewnią bardziej przydatne wytyczne oparte na podejściu medycyny precyzyjnej, umożliwiając nam pełną konfrontację z alergiami pokarmowymi.
DR MAURO CALVANIU OC di Pediatria, Azienda Ospedaliera S. Camillo Forlanini, Włochy
DR CATERINA ANANIA Dipartimento Materno Infantile e Scienze Urologiche, Policlinico Umberto I, “La Sapienza” Università di Roma, Włochy
PROF. DR CARLO CAFARELLI Clinica Pediatrica, Dipartimento di Medicina e Chirurgia, Università di Parma, Włochy
i współpracownicy: dr Alberto Martelli, prof. Michele Miraglia del Giudice, lek. med. Claudio Cravidi, dr Marzia Duse, dr Sara Manti, Dr Maria Angela Tosca, Prof. dr Fabio Cardinale, dr Elena Chiappini, dr Francesca Olivero, prof. Gian Luigi Marseglia
BIBLIOGRAFIA
Calvani M te al. Food allergy: an updated review on pathogenesis, diagnosis, prevention and management. Acta Biomed. 2020 Sep 15;91(11-S):e2020012. https://pmc.ncbi.nlm.nih.gov/articles/PMC8023067/

 Nasze magazyny
Nasze magazyny