Gdy dana osoba staje się otyła, komórki tłuszczowe (adipocyty) zwiększają swój rozmiar, dlatego tkanka tłuszczowa staje się większa, a przez to także dysfunkcyjna. Powiększona tkanka tłuszczowa uwalnia nadmiar wolnych kwasów tłuszczowych (FFA), reaktywnych form tlenu (ROS) i cytokin prozapalnych.
Nadmiar ogólnoustrojowych FFA i lipidów z pokarmu dostaje się do komórek narządów innych niż tkanka tłuszczowa, takich jak wątroba, mięśnie i trzustka, gdzie odkłada się w postaci tłuszczu, prowadząc do lipotoksyczności.
Szkodliwe lipidy rozregulowują organelle, czyli struktury wewnątrzkomórkowe, które zaczynają uwalniać reaktywne formy tlenu (ROS), powodując ogólnoustrojowy stan zapalny, hamujący działanie insuliny i zaburzający homeostazę glukozy, co prowadzi do dysregulacji całego organizmu.
Długotrwała otyłość i spożywanie nadmiernej liczby kalorii sprzyja zatem insulinooporności i rozwojowi ogólnoustrojowego stanu zapalnego, stwarzając w ten sposób warunki do rozwoju chorób.
Artykuł jest skróconą i uproszczoną wersją publikacji naukowej.
Otyłość ma już charakter epidemii i stanowi poważny problem dla zdrowia publicznego. W Stanach Zjednoczonych otyłość jest drugą przyczyną zgonów, której można zapobiegać. Problem wzrósł prawie trzykrotnie od 1975 roku i szacuje się, że do 2030 roku 51% populacji będzie otyła. W przypadku otyłości i spożywania zbyt dużych ilości pokarmu, nadmiar kalorii jest przechowywany w postaci lipidów w tkance tłuszczowej, powodując jej powiększenie. W przypadku długotrwałego przejadania się, nadmiar wolnych kwasów tłuszczowych (FFA) zostaje natomiast zmagazynowany w różnych narządach, jako tłuszcz ektopowy – wytwarza on reaktywne form tlenu (ROS) i działa prozapalnie. Ten stan odgrywa kluczową rolę w rozwoju insulinooporności.

Jak działa insulina i skąd bierze się insulinooporność?
Insulina jest hormonem wydzielanym przez komórki β trzustki w odpowiedzi na stężenie glukozy i kwasów tłuszczowych we krwi. Funkcją metaboliczną insuliny jest zatem utrzymanie homeostazy glukozy i lipidów.
Kiedy przyjmujemy posiłek, poziom glukozy we krwi wzrasta. Komórki β trzustki wyczuwają to i uwalniają insulinę w zależności od ilości glukozy. Insulina wiąże się z receptorami komórkowymi głównie w mięśniach szkieletowych, tkance tłuszczowej i w wątrobie i umożliwia glukozie wejście do komórek, gdzie zostaje ona włączona w przemiany energetyczne oraz procesy syntezy kwasów tłuszczowych i białek.
Gdy komórki nie reagują odpowiednio na insulinę i nie mogą wykorzystywać glukozy do metabolizmu energetycznego, poziom tego cukru we krwi wzrasta, a komórki β trzustki odpowiadają coraz większym wydzielaniem insuliny, aby zrekompensować wysoki poziom glukozy we krwi – tak zaczyna się insulinooporność.
W miarę jej rozwoju, komórki β walczą, produkując coraz więcej insuliny w odpowiedzi na utrzymujący się wysoki poziom glukozy. Jeśli stan insulinooporności trwa przez miesiące i lata, komórki β nieustannie ciężko pracują produkując i z czasem, z przeciążenia, tracą zdolność regulowania poziomu glukozy.
Czy insulinooporność może prowadzić do cukrzycy?
Podwyższony poziom glukozy we krwi, zmniejszona wrażliwość na insulinę i zwiększone jej wydzielanie obserwuje się około 13 lat przed pełnym rozpoznaniem cukrzycy typu 2 (T2DM). Całkowity czas od początku wystąpienia okoliczności sprzyjających insulinooporności do T2DM można podzielić na trzy etapy.
- Pierwszy etap to długi okres kompensacyjny, w którym rozwija się insulinooporność, podnosi poziom glukozy we krwi i zwiększa masa komórek β.
- Drugi etap to okres adaptacji, kiedy komórki β nie są już w stanie w pełni kompensować rosnącej insulinooporności. Pierwsze dwa etapy występują przed osiągnięciem fazy przedcukrzycowej.
- Trzeci etap to rozwój stanu przedcukrzycowego i T2DM – na tym etapie komórki β stają się dysfunkcyjne i nie są w stanie zrekompensować insulinooporności, co z kolei powoduje gwałtowny wzrost poziomu glukozy we krwi. U około 25–70% pacjentów stan przedcukrzycowy przekształca się w T2DM w ciągu 3–5 lat, a u 80% z nich pojawia się niealkoholowe stłuszczenie wątroby.
Insulinooporność zwiększa również ryzyko niewydolności serca, sprzyja nowotworom i pogarsza funkcje poznawcze, które zwiększają ryzyko rozwoju choroby Alzheimera.
Ryzyko rozwoju insulinooporności wzrasta u osób otyłych, z upośledzoną tolerancją glukozy, alkoholików i palaczy, a także przy hipercholesterolemii (zwiększone stężenie cholesterolu we krwi), hipertrójglicerydemii (podniesiony poziom trójglicerydów we krwi), niski poziom dobrego cholesterolu HDL, hiperurykemii (nadmiar kwasu moczowego we krwi) i nadciśnieniu tętniczym. Osoby otyłe rozwijają insulinooporność w określonych momentach swojego życia w ponad 80% przypadków.
Czym tak naprawdę jest otyłość?
Otyłość to choroba, w której nadmiar tkanki tłuszczowej nagromadzi się w stopniu, który może mieć niekorzystny wpływ na zdrowie. Otyłość jest definiowana przez amerykański Narodowy Instytut Zdrowia (NIH) na podstawie wskaźnika masy ciała (BMI), obliczanego jako iloraz wagi osoby w kilogramach i kwadratu wzrostu w metrach.
Jeśli BMI przekracza 30, osoba jest uważana za otyłą. Zwiększenie masy tłuszczowej prowadzi do powiększenia rozmiaru komórek tłuszczowych (hipertrofia) i zwiększenia ich liczby (proliferacja), co skutkuje powiększeniem objętości tkanki tłuszczowej (hiperplazja).
Nadmierne gromadzenie się tkanki tłuszczowej zwykle wynika z przyjmowania większej ilości składników odżywczych niż potrzebuje organizm. Ich nadmiar jest przechowywany w postaci trójglicerydów (rodzaj tłuszczów) w adipocytach.
Warto zaznaczyć, że tkanka tłuszczowa jest dużym i dynamicznym narządem endokrynnym (tzn. wydziela hormony), odpowiedzialnym za magazynowanie energii, stanowiącym od 2–70% masy ciała u ludzi. Gdy adipocyty nie są w stanie wchłonąć nadmiaru trójglicerydów, organizm wytwarza nowe komórki tłuszczowe.
Proces ten nazywany jest adipogenezą i prowadzi do zwiększenia objętości tkanki tłuszczowej, by mogła ona podołać wymogom organizmu. Tkankę tłuszczową dzielimy na dwa rodzaje: podskórną i trzewną. Tkanka podskórna gromadzi się głównie w pośladkach, na udach i pod skórą brzucha, a trzewna w okolicach żołądka, krezki i wokół nerek.
Badania wykazały, że otyłość często wiąże się z tworzeniem dysfunkcyjnej tkanki tłuszczowej – zahamowana zostaje jej hiperplazja i dochodzi do przerostu adipocytów (stąd jej nazwa – otyłość hipertroficzna), która prowadzi do zaburzeń metabolizmu.
Otyłość hipertroficzna często ma charakter otyłości brzusznej, która jest szkodliwa dla zdrowia metabolicznego, rekrutuje makrofagi i inne komórki odpornościowe, promuje ogólnoustrojowy stan zapalny i tworzy środowisko sprzyjające odkładaniu tkanki tłuszczowej.
Badania kliniczne wykazały, że im większy rozmiar adipocytów w okolicach żołądka, tym wyższe ryzyko insulinooporności, a ponadto nawet stan zapalny w podskórnej tkance tłuszczowej, do którego dochodzi u umiarkowanie otyłych kobiet, jest związany z insulinoopornością.
Około 10–25% osób otyłych jest metabolicznie zdrowych, ponieważ ich organizmy zachowują wrażliwość na działanie insuliny – to doprowadziło m.in. do stwierdzenia, że można być zdrowym otyłym. Jednak najnowsze badania wykazały, że metabolicznie zdrowa otyłość nie istnieje i jest to stan szkodliwy – chociaż pacjent może pozostać wolny od chorób metabolicznych przez dziesięciolecia, stan taki zwiększa ryzyko nagłych i zagrażających życiu zdarzeń sercowo-naczyniowych.
U niektórych osób z zaburzeniami metabolicznymi ilość tłuszczu trzewnego przeważa nad ilością podskórnej tkanki tłuszczowej, co przyczynia się do insulinooporności. Otyłość zwiększa ponadto ryzyko rozwoju chorób nerek, choroby zwyrodnieniowej stawów, nowotworów, cukrzycy, bezdechu sennego, niealkoholowego stłuszczenia wątroby, nadciśnienia i chorób sercowo-naczyniowych.

Częstość występowania otyłości

Jakie są czynniki ryzyka otyłości?
Istnieje wiele czynników ryzyka otyłości, z których niektóre są zależne od środowiska i stylu życia, a inne są niezależne. Pomijając czynniki środowiskowe, niezależne czynniki ryzyka są modyfikowalne i możemy je zmieniać. Czynniki środowiskowe maja olbrzymi wpływ na rozwój otyłości.
1. Dieta - wysokoprzetworzone produkty
Wśród nich jest zachodnia dieta – wysokoenergetyczne pokarmy są łatwo dostępne i tanie, można je także kupić dosłownie wszędzie.
Te wysokoprzetworzone i niezdrowe produkty spożywcze są także intensywnie reklamowane w telewizji i radio. Co ważne, sięgają po nie głównie osoby o niższym statusie społeczno-ekonomicznym, ponieważ dostęp do tych produktów jest łatwy i są one tańsze, niż pokarmy zdrowe.
2. Wysiłek fizyczny
Wśród czynników środowiskowych jest także dostępność obiektów rekreacyjnych – jeżeli znajdują się one w najbliższej okolicy, łatwiej jest ustrzec się przed otyłością, podczas gdy ograniczony dostęp do aktywności fizycznej lub zajęć rekreacyjnych jest związany ze zwiększonym ryzykiem otyłości.
3. Temperatura otoczenia
Temperatura otoczenia również odgrywa tu pewną rolę. Wydatek energetyczny zwiększa się lub maleje wraz ze wzrostem lub spadkiem temperatury otoczenia.
Ciało człowieka utrzymuje optymalną temperaturę, która jest wyższa niż temperatura otoczenia. W chłodniejszych warunkach organizm ludzki zwiększa tempo metabolizmu, wzrasta ono również, gdy temperatura otoczenia jest wyższa.
Dzięki powszechnej kontroli temperatury poprzez ogrzewanie i klimatyzację w samochodach, domach i miejscach pracy, cieszymy się komfortowymi temperaturami, w których zapotrzebowanie na energię jest zminimalizowane, ze względu na to, że przebywamy w strefie neutralnej termicznie, a to zwiększa ryzyko rozwoju otyłości.
4. Uwarunkowania genetyczne
Uwarunkowania genetyczne również są czynnikiem ryzyka. Geny mogą bowiem wpływać na ilość i rozmieszczenie tkanki tłuszczowej w organizmie, oddziałują również na to, jak skutecznie organizm wykorzystuje żywność do wytwarzania energii.
Dieta i styl życia (w tym narażenie na głód), otyłość rodziców, palenie tytoniu i ekspozycja na różne substancje chemiczne, zaburzenia endokrynologiczne, przyrost masy ciała podczas ciąży i cukrzyca ciążowa modyfikują ekspresję genów, co przekłada się na wyższe ryzyko otyłości u potomstwa.

5. Mikrobiota jelitowa
Kolejnym czynnikiem jest mikrobiota. Ludzkie jelita zawierają miliardy drobnoustrojów – ich liczba jest ponad dziesięciokrotnie większa niż liczba komórek ludzkiego ciała.
Na skład mikrobioty jelitowej wpływ ma dieta, wiek, przebyte porody, karmienie piersią, stosowanie antybiotyków, pochodzenie etniczne, genetyka gospodarza i przyjmowane leki. Dieta i siedzący tryb życia są natomiast najważniejszymi modulatorami mikrobiomu.
Niskokaloryczne diety z dużym udziałem błonnika zwiększają różnorodność mikrobioty jelitowej (to stan bardzo pożądany, im bowiem większa różnorodność miokrobioty jelitowej, tym zdrowszy jest mikrobiom), podczas gdy diety wysokokaloryczne zmniejszają ją.
U osób otyłych obserwuje się także wzrost poziomu krótkołańcuchowych kwasów tłuszczowych i zmniejszenie zawartości kalorii w kale, dlatego zakłada się, że spożywają one więcej wysokokalorycznych pokarmów niż osoby szczupłe.
Zmiana diety, trening i operacje bariatryczne nie prowadzą do natychmiastowych zmian w składzie mikrobiomu, naukowcy zakładają, że mikrobiota jelitowa potrzebuje dużo czasu, aby dostosować się do nowych okoliczności, a ze względu na swoją trwałość może wymagać wieloletniego przestrzegania zaleceń dietetycznych i reżimu treningowego, by doszło w niej do zmian, wspierających utratę masy ciała.
Pokarmy i napoje, które spożywamy każdego dnia, także odgrywają istotną rolę w naszym ogólnym stanie zdrowia. Ciało ludzkie musi pozyskiwać z nich niezbędne składniki odżywcze: białka, węglowodany, tłuszcze, witaminy i minerały.
Urbanizacja i wzrost komfortu życia sprawiły, że typowa dieta zawiera duże ilości cukrów, tłuszczu i mięsa oraz fastfoodów, czyli składników, które zastąpiły tradycyjne diety bogate w węglowodany i tłuszcze oraz unikalne tradycyjne zdrowe nawyki żywieniowe.
Przejadanie się cukrem i tłuszczami nasyconymi to częsta przyczyna otyłości. Trzeba także uważać na tzw. cukier dodany (glukoza, sacharoza, maltoza, dekstroza czy fruktoza), ponieważ tak jak cukier biały podnoszą one poziom glukozy we krwi.
Wysoki poziom glukozy bezpośrednio upośledza natomiast wrażliwość na insulinę hepatocytów, czyli komórek wątroby, i prowadzi do glukotoksyczności (to stan, w którym stale utrzymujący się wysoki poziom glukozy we krwi, zaczyna niekorzystnie wpływać na pracę organizmu).
Także wysokie spożycie tłuszczów nasyconych wiązało się z wyższym ryzykiem otyłości, ponieważ posiłki o wysokiej zawartości tłuszczów nasyconych zmniejszają wrażliwość komórek na insulinę i zwiększają poposiłkowy poziom glukozy we krwi oraz przyczyniają się do rozwoju stanu zapalnego.
W jaki sposób otyłość szkodzi naszym komórkom?
Rozmiar adipocytów powiększa się wraz z przyrostem masy ciała. Prowadzi to jednocześnie do śmierci wielu z nich z powodu niewystarczającej podaży tlenu, która nie nadąża za rozrostem tkanki tłuszczowej.
Powiększone adipocyty zaczynają uwalniać następnie wolne kwasy tłuszczowe (FFA), reaktywne formy tlenu (ROS) i cytokiny prozapalne oraz adipokiny – to aktywne biologicznie substancje, wytwarzane przez komórki tłuszczowe, które wywierają wpływ na metabolizm własnej tkanki i okolicznych tkanek oraz całego organizmu.
Niektóre z nich ściągają do tkanki tłuszczowej monocyty, rodzaj białych krwinek, które przekształcają się w makrofagi, które zamiast zmniejszać stan zapalny, nasilają go, uwalniając cytokiny i ściągając jeszcze więcej monocytów.
Ostatecznie dysfunkcyjna tkanka tłuszczowa u osób otyłych prowadzi do rozwoju ogólnoustrojowego stanu zapalnego o niskim stopniu nasilenia. A zwiększenie poziomu niektórych cytokin prowadzi do insulinooporności w tkance tłuszczowej, mięśniach i wątrobie oraz upośledzenia działania insuliny.
Przewlekła nadprodukcja wolnych kwasów tłuszczowych prowadzi z kolei do lipotoksyczności w komórkach mięśni, serca, wątroby, trzustki i innych narządów.
Tkanka tłuszczowa, jeżeli jest jej zbyt dużo, wydziela bowiem toksyczne lipidy (w tym ceramidy) i wolne rodniki tlenowe, sprzyja ponadto uszkodzeniom struktur wewnątrzkomórkowych i stanom zapalnym oraz nasila apoptozę, czyli programowaną śmierć komórek. Tłuszcze pochodzące z diety również wpływają na wewnątrzkomórkowe szlaki sygnałowe i działają prozapalnie.

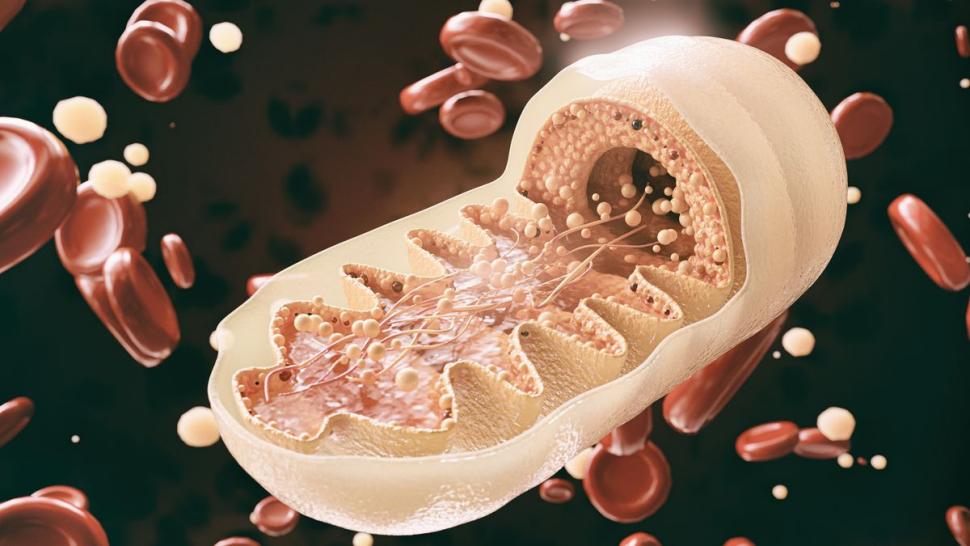
Mitochondria to organelle komórkowe wytwarzające energię i magazynujące ją w postaci adenozynotrójfosforanu (ATP). Mają one zdolność szybkiej adaptacji do zmiennych warunków metabolicznych, m.in. poprzez dokonywanie fuzji lub rozszczepiania, apoptozę oraz mitofagię, proces, w którym organizm sam usuwa uszkodzone lub niezdolne do prawidłowego funkcjonowania organelle. Dysfunkcja mitochondriów upośledza produkcję energii i powoduje szereg niekorzystnych zmian metabolicznych.
Aby uniknąć nieprawidłowości, organizm dokonuje rozszczepienia mitochondriów, w wyniku czego ich fragmenty przekształcają się w małe kuliste organelle. To zmniejsza ich zdolność do wytwarzania energii, prowadzi do uszkodzenia mitochondrialnego DNA, generuje duże ilości wolnych rodników tlenowych i indukuje stres oksydacyjny, czyli stan, w którym organizm przestaje radzić sobie z nadmiarem wolnych rodników tlenowych oraz apoptozę.
Dysfunkcja mitochondriów nasila z kolei mitofagię i prowadzi do zmniejszenia liczby mitochondriów, co przyczynia się do akumulacji lipidów przy nadmiernej podaży pokarmów oraz indukuje lipotoksyczność i apoptozę komórek. Badania dowiodły, że otyłość i nadmierne spożycie kalorii są głównym winowajcą wspomnianych dysfunkcji mitochondriów.
Organelle te mogą ulegać uszkodzeniom – mitochondria w mięśniach szkieletowych stają się mniejsze i krótsze, co upośledza ich funkcjonowanie, podobnie wysoki poziom glukozy powoduje fragmentację mitochondriów komórek wątroby i mięśni oraz przyczynia się do wzrostu poziomu wolnych rodników tlenowych.
Mitochondria osób otyłych są ponadto inne niż u osób szczupłych. U otyłych pacjentów, jak już wspomnieliśmy, morfologia mitochondriów ulega zmianie. Ich biogeneza (proces tworzenia) także ulega upośledzeniu.
Podczas wytwarzania energii powstaje w nich dużą ilość wolnych rodników tlenowych, a niepełne utlenianie kwasów tłuszczowych prowadzi do wytworzenia szkodliwych metabolitów – z powodu przeciążenia lipidami i glukozą mitochondria wytwarzają niekontrolowane ilości ROS (w zdrowych organellach jest to mniej niż 5% pobranego tlenu), które uszkadzają DNA i błony lipidowe, a także białka i enzymy w mitochondrialnym łańcuchu oddechowym.
Stan ten prowadzi do stresu oksydacyjnego, który działa prozapalnie i zmniejsza wrażliwość komórek na działanie insuliny. Innym możliwym mechanizmem, odpowiedzialnym za wytwarzanie ROS, są enzymy obecne w błonie komórkowej, których zadaniem jest ochrona przed patogenami właśnie przy pomocy wolnych rodników tlenowych, wydzielanych pod wpływem działania insuliny. Jednak przy wysokim poziomie glukozy we krwi i w stanie insulinooporności u osób otyłych mechanizm ten ulega rozregulowaniu i wspomniane enzymy zaczynają nam szkodzić poprzez niekontrolowane wytwarzanie ROS.
Retikulum endoplazmatyczne, jest kolejnym organellum w komórce, które cierpi m.in. wskutek insulinooporności i wysokiego poziomu glukozy we krwi, będących wynikiem nieprawidłowej diety i otyłości. Podstawowymi funkcjami retikulum są synteza, fałdowanie i transport białek, utrzymuje ono również homeostazę jonów wapnia i reguluje syntezę lipidów, w tym biosyntezę cholesterolu, fosfolipidów i ceramidów.
Stres oksydacyjny w retikulum endoplazmatycznym uznano za kluczowy czynnik w rozwoju dysfunkcji metabolicznych, związanych z nadmiernym przybieraniem na wadze. Przy czym badanie z udziałem ochotników wykazało, że stres oksydacyjny retikulum endoplazmatycznego w tkance tłuszczowej i wątrobowej osób otyłych ulega zmniejszeniu po utracie masy ciała, zatem proces ten można odwrócić.
Okazuje się także, że wskutek nadmiernego spożycia kalorii i otyłości wątroba zwiększa lipogenezę (wytwarzanie lipidów) i glukoneogenezę (wytwarzanie glukozy z niecukrowych substratów), co dodatkowo obciąża organizm nadmiarem tych substancji.
Lizosomy, także jedno z organellum, degradują, recyklingują i wytwarzają białka, lipidy i inne organelle biorą również udział w usuwaniu uszkodzonych organelli i wadliwych produktów przemiany materii w procesie zwanym autofagią. Ta ostatnia jest niezbędna do łagodzenia stresu oksydacyjnego, usuwania ROS i utrzymania homeostazy, czyli stanu zdrowej równowagi komórkowej.
Wskutek nadmiernego spożycia węglowodanów, kwasów tłuszczowych i aminokwasów, zwiększeniu ulega poziom jednego z białek regulatorowych, hamujących autofagię – kinazy mTOR.
W przeciwieństwie do tego, w przypadku niedoboru składników odżywczych, kinaza zwana AMPK pośredniczy w hamowaniu mTOR i aktywuje autofagię. Proces ten jest niezbędny do utrzymania homeostazy lipidów, ponieważ ich nadmierne odkładanie zwiększa ryzyko dysfunkcji hepatocytów i hamuje autofagię.
Otyłość zaburza proces autofagii, a to z kolei zwiększa akumulację nieprawidłowych białek i lipidów, co prowadzi do dysfunkcji retikulum i mitochondriów oraz insulinooporności. Badania wykazały, że otyłość i nadmierne spożycie kalorii zwiększają autofagię w tkance tłuszczowej i zmniejsza ją w wątrobie i trzustce, co ciekawe, tkanka mięśniowa pozostaje nienaruszona. Tym, co z kolei uruchamia autofagię, jest deficyt kalorii i post.
Podsumowanie
Istnieje wiele czynników, zwiększających ryzyko otyłości i dysfunkcji tkanki tłuszczowej. Jej nadmiar uwalnia w zbyt dużych ilościach wolne kwasy tłuszczowe, reaktywne formy tlenu i cytokiny prozapalne, które indukują insulinooporność na wczesnym etapie.
Także wolne kwasy tłuszczowe i lipidy z diety przedostają się do komórek różnych narządów, generując w nich tworzenie toksycznych lipidów, np. ceramidów. Te następnie rozregulowują funkcje organelli komórkowych, takich jak mitochondria, retikulum endoplazmatyczne i lizosomy. Utrzymująca się otyłość i nadmierne spożywanie kalorii pogłębiają te patologiczne zmiany, dlatego też, jeśli jedno organellum zaczyna szwankować, inne też zaczynają działać nieprawidłowo.
Proces ten może powodować upośledzenie metabolizmu komórek, problemy ogólnoustrojowe i pobudzać apoptozę. Z powodu dysfunkcji na poziomie komórkowym i ogólnoustrojowym, wrażliwość na insulinę i homeostaza glukozy ulegają zaburzeniu, co dodatkowo zwiększa poziom wolnych kwasów tłuszczowych i nasila odkładanie lipidów w narządach.
Proces ten powoduje zwiększenie stanów zapalnych i poziomu reaktywnych form tlenu. Aby temu przeciwdziałać, komórki odpornościowe gromadzą się w obszarach objętych stanem zapalnym i rozwija się insulinooporność.
W warunkach insulinooporności insulina nie może prawidłowo działać w celu zachowania homeostazy glukozy. Komórki β trzustki w odpowiedzi na zwiększony poziom glukozy w krążeniu, uwalniają coraz więcej insuliny, aby to zrekompensować.
Z jednej zatem strony długotrwała otyłość wywołuje przewlekły ogólnoustrojowy stan zapalny o niskim stopniu nasilenia, upośledza wrażliwość na insulinę, zwiększa prawdopodobieństwo wystąpienia różnych chorób przewlekłych, z drugiej sama insulinooporność i towarzyszące jej procesy, utrudniają odzyskanie kontroli nad masą ciała i sprzyjają pogłębianiu otyłości. Dlatego kluczowe wydaje się tu odzyskanie kontroli nad poziomem glukozy we krwi i zbilansowanie ilości przyjmowanych kalorii.
DR RIFAT SULTANA, South Dakota State University, USA
PROF. MICHAEL W. GREENE, dietetyk, Auburn University, USA
- Adipose tissue and insulin resistance in obese. Biomed Pharmacother. 2021 May:137:111315.
- Źródło: https://pubmed.ncbi.nlm.nih.gov/33561645/

 Nasze magazyny
Nasze magazyny