36 mln ludzi na całym świecie jest niewidomych, a jeśli wierzyć prognozom zawartym w raporcie opublikowanym przez „Lancet Global Health” do 2050 r. liczba ta zwiększy się ponad 3-krotnie! Nic więc dziwnego, że naukowcy na całym świecie pracują nad sposobami odzyskania wzroku.
Jedną z opcji jest keratoplastyka drążąca, czyli przeszczep rogówki. Zabieg ten jest niezwykle ważny w świetle danych Światowej Organizacji Zdrowia (WHO), z których wynika, że schorzenia rogówki są jedną z najczęstszych – po jaskrze i zaćmie – przyczyn ślepoty na świecie, a według amerykańskiego Vision Share Consortium of Eye Banks cierpi na nie grubo ponad 10 mln ludzi1.
Przełom w leczeniu chorób rogówki
Rogówka oka ludzkiego to przezroczysta blaszka, która tworzy przednią ścianę gałki ocznej. Jest przejrzysta, kształtem przypomina kopułę i wygląda jak soczewka kontaktowa. Rogówka oczna jest bardzo ważnym elementem układu optycznego oka – to przez nią do oka wpada światło. Jej zadaniem jest załamywanie i skupianie promieni, co sprawia, że widzimy wyraźnie.
Nawet niewielkie zmiany, które są odstępstwem od normy i powstają w wyniku chorób rogówki, powodują ból oraz znaczne pogorszenie widzenia, a nieleczone mogą prowadzić do ślepoty.
Często jedyną metodą na odzyskanie wzroku w takich przypadkach jest transplantacja tego narządu. Choć trudno w to uwierzyć, pierwszą udaną operację przeszczepienia rogówki wykonano ponad 100 lat temu. Dokonał tego 7 grudnia 1905 r. w Ołomuńcu austriacki okulista Eduard Zirm2.
Niestety mimo lat doświadczeń keratoplastyka nie jest powszechną procedurą. Brakuje dawców i przeszczepu tej struktury doczeka tylko 1 na 70 potrzebujących. Tymczasem wzrok z powodu chorób rogówki traci 1 mln osób rocznie. Jednak to może się zmienić dzięki sztucznym rogówkom wytworzonym z kolagenu ze świńskiej skóry.

Sztuczne rogówki z kolagenu świńskiego
W zeszłym roku na łamach Nature Biotechnology zespół uczonych ze Szwecji, Indii i Iranu opisał wyniki pilotażowego badania z udziałem 20 osób, z których 14 straciło wzrok z powodu zaawansowanego stożka rogówki, a 6 było u progu utraty widzenia przez tę chorobę. Pacjentom przeszczepiono sztuczną rogówkę. Chorzy nie tylko odzyskali wzrok, ale przez kolejne 2 lata nie pojawiły się u nich żadne komplikacje.
Po operacji przez 8 tygodni przyjmowali krople do oczu, które zapobiegały jej odrzuceniu. To dodatkowy sukces, gdyż osoby, które są po przeszczepie naturalnej rogówki, muszą stale przyjmować leki immunosupresyjne.
Wszczepione rogówki wykonano z kolagenu ze świńskiej skóry, która jest produktem odpadowym w przemyśle spożywczym. To oznacza, że materiał taki jest łatwo dostępny i tani. Wytworzone z niego rogówki mogą być przechowywane do 2 lat. To ich kolejna zaleta, gdyż rogówki naturalne nadają się do użycia jedynie przez 2 tygodnie3.
Uzyskane wyniki pokazują, że możliwe jest opracowanie biomateriału, który spełnia wszystkie kryteria stawiane przed implantami dla ludzi i który nie dość, że może być masowo produkowany, to jeszcze da się go przechowywać przez jakiś czas. To zaś oznacza, możliwość rozwiązania problemu braku rogówek do transplantacji i daje nadzieję na leczenie innych chorób oczu – mówi profesor Neil Lagali z Linköping Universitet w Szwecji. Kolejne korzyści niesie ze sobą sama procedura przeszczepiania sztucznej rogówki. W zastosowanej przez naukowców metodzie nie trzeba usuwać rogówki pacjenta.
Laserem wykonuje się niewielkie nacięcie, przez które wsuwa się implant – wyjaśnia prof. Lagali. – Co więcej, wszczepionej rogówki nie trzeba przyszywać. Ta prostota zabiegu sprawia, że będzie on możliwy do przeprowadzenia nawet w małych i słabiej wyposażonych placówkach.
Rzecz jasna autorzy badania zastrzegają, że konieczne są szerzej zakrojone testy kliniczne nowej metody. Oni zaś skupią się teraz na zbadaniu, czy ich technologię można wykorzystać do leczenia szerszej gamy chorób oczu i czy sztuczne soczewki można będzie zindywidualizować, uzyskując w ten sposób większą efektywność.
Geny w zaprzęgu
Jest również nadzieja dla osób zmagających się z innymi schorzeniami upośledzającymi widzenie. Jak się okazuje, naukowcy mogą pochwalić się sukcesami zarówno w odwracaniu jaskry poprzez rewitalizację nerwu wzrokowego, jak i odwróceniu niektórych schorzeń siatkówki.
Nowe badanie na myszach dostarcza intrygujących dowodów na to, że sprytna terapia genowa może nie tylko cofnąć biologiczny zegar w starzejących się komórkach siatkówki, ale też odwrócić utratę wzroku z powodu jaskry, która jest główną przyczyną ślepoty na całym świecie. Jest to pierwsze udana próba odwrócenia choroby, a nie tylko powstrzymania jej postępu!
Eksperymenty przeprowadzone z udziałem uczonych z Harvard Medical School, Yale School of Medicine i Massachusetts General Hospital bazowały na nagrodzonym w 2012 r. Noblem odkryciu Shin’ya Yamanaki. Zidentyfikował on 4 czynniki transkrypcyjne (OCT4, SOX2, KLF4 i C-MYC) – białka, które mogą usuwać znaczniki epigenetyczne na komórkach i przywrócić te komórki do ich prymitywnego stanu embrionalnego, od którego mogą się one rozwinąć się w dowolny inny rodzaj komórki.
W swojej pracy Amerykanie napotkali jednak pewne problemy. Okazało się, że zastosowane u dorosłych myszy, wszystkich 4 czynników Yamanaka może wywoływać wzrost guza lub doprowadzić do całkowitego zresetowania stanu komórkowego, przez co dojdzie do wymazania tożsamości komórek poddanych zabiegowi.
Naukowcy znaleźli jednak sposób na obejście tych przeszkód i eliminację niebezpieczeństwa, po prostu pomijając jedno z białek. Użyli nieszkodliwego wirusa do wprowadzenia 3 z 4 czynników Yamanaki (OCT4, SOX2, KLF4) do siatkówki myszy. W ten sposób przeprogramowali komórki chorych zwierząt.
Okazało się, że terapia przyniosła wiele korzyści: promowała regenerację uszkodzonego nerwu wzrokowego, odwróciła utratę wzroku u gryzoni ze stanem naśladującym ludzką jaskrę (odzyskały one ok. 50% utraconych uprzednio zdolności wizualnych), a ponadto odwróciła utratę wzroku u starzejących się zwierząt bez jaskry.
Aby sprawdzić, czy zdolność regeneracyjną młodych zwierząt można przekazać dorosłym myszom, uczeni dostarczyli zmodyfikowaną kombinację 3 genów za pomocą wirusa AAV do komórek zwojowych siatkówki dorosłych myszy z uszkodzeniem nerwu wzrokowego.
Okazało się, że terapia spowodowała 2-krotny wzrost liczby przeżywających komórek zwojowych siatkówki po urazie i 5-krotny wzrost nerwów i powstanie nowych połączeń z mózgiem.
Nasze badanie pokazuje, że możliwe jest bezpieczne odmłodzenie złożonych tkanek, takich jak siatkówka i przywrócenie ich młodzieńczych funkcji biologicznych – mówi współautor badania prof. David Sinclair, genetyk w Blavatnik Institute w Harvard Medical School. I od razu ostrzega. – Ustalenia te należy powtórzyć, stosując różne modele zwierzęce, przed jakimikolwiek eksperymentami na ludziach.
Amerykanie muszą jeszcze zbadać, w jaki sposób czynniki odbudowujące wpływają na inne rodzaje komórek i tkanek oraz sprawdzić, czy odmłodzenie tkanek będą się utrzymywać. Jeśli jednak ich ustalenia zostaną potwierdzone, mogą w ciągu 2 najbliższych lat rozpocząć badania kliniczne w celu przetestowania skuteczności podejścia u osób z jaskrą4.
Terapię genową zastosował również zespół prof. Michela Cayouette z Université de Montréal, który dzięki użyciu 2 genów, był w stanie pobudzić uśpione komórki Müllera, tak by te przekształciły się w neurony siatkówki.
Interesujące jest to, że komórki Müllera znane są z reaktywowania i regenerują siatkówki u ryb, ale u ssaków, w tym ludzi, normalnie tego nie robią, ani po urazie, ani chorobie. I nie rozumiemy jeszcze w pełni dlaczego – mówi współautorka badania Camille Boudreau-Pinsenault.
Być może pewnego dnia będziemy w stanie skorzystać z komórek, które są zwykle obecne w siatkówce i pobudzić je do regeneracji komórek siatkówki utraconych w wyniku choroby do przywróceniu widzenia – dodaje kolejny członek zespołu Ajay David. Naukowcy planują teraz udoskonalić skuteczność tej techniki i znaleźć sposób na promowanie pełnego przekształcania się komórek Müllera w fotoreceptory, które mogłyby przywrócić wzrok pacjentom cierpiących na zwyrodnieniową chorobę siatkówki5.
Do walki ze ślepotą geny zaprzęgli również uczeni z renomowanych uczelni w Wielkiej Brytanii (Cambridge), USA (NIH), Australii (University of Melbourne), Czechach (CAS) i Szwecji (Karolinska Institutet). Zauważyli oni, że gen odpowiedzialny za wytwarzanie białka o nazwie protrudyna może stymulować regenerację komórek nerwowych i chronić je przed śmiercią po urazie.
W czasie badania prowadzonego na hodowli komórek mózgowych, których aksony uszkodzili laserem, zaobserwowali, że zwiększenie ilości lub aktywności protrudyny znacząco zwiększyło ich zdolność do regeneracji.
Wypustki (aksony) komórek nerwowych w siatkówce (znanych jako komórki zwojowe siatkówki), tworzą w niej warstwę włókien nerwowych, które zbiegając się, formują nerw wzrokowy łączący ją z mózgiem. To właśnie tą drogą przekazywane i przetwarzane są informacje wizualne.
Aby zbadać, czy protrudyna może stymulować naprawę uszkodzonego nerwu wzrokowego, naukowcy zastosowali technikę terapii genowej w celu zwiększenia jej ilości i aktywności w oku i nerwie wzrokowym. Kiedy oceniali przebieg regeneracji kilka tygodni po urazie nerwu wzrokowego, stwierdzili, że białko umożliwiło aksonom regenerację na duże odległości. Odkryli również, że komórki zwojowe siatkówki były chronione przed śmiercią.
Dowodzi to, że technika ta może pomóc chronić wzrok przed jaskrą, w której przebiegu nerw wzrokowy, zostaje stopniowo uszkodzony w związku z podwyższonym ciśnieniem w oku.
Co więcej, kolejny eksperyment wykazał, że zwiększona ilość protrudyny jest w stanie niemal całkowicie chronić neurony siatkówki myszy przed niszczącym wpływem jaskry.
Być może nasza strategia opierająca się na stosowaniu terapii genowej – będącej już w użyciu klinicznym – w celu dostarczenia tego konkretnego białka do oka, pozwoli stymulować aksony komórek zwojowych siatkówki do odrastania – rozważa dr Veselina Petrova z Department of Clinical Neurosciences na University of Cambridge. Jednak zastrzega przy tym, że to wymagałoby dalszych badań, aby sprawdzić, czy można skutecznie zastosować to samo podejście w leczeniu ludzi.
Co ciekawe, podczas tych eksperymentów, badacze wykazali, że obecne w oku retikulum endoplazmatyczne (siateczka śródplazmatyczna) – będące wewnątrzkomórkowym i międzykomórkowym system kanałów – wydaje się dostarczać materiały i inne struktury komórkowe ważne dla wzrostu i przeżycia w celu wsparcia procesu regeneracji po urazie, a protrudyna stymuluje ich transport do miejsca urazu6.
Implanty mózgowe przywracają częściowy wzrok
Tak, ten cud dokonuje się na naszych oczach. W 2021 r. w Elche w Hiszapanii od 16 lat niewidomej Bernardecie Gómez wszczepiono do płatu potylicznego – części mózgu odpowiedzialnej za przetwarzanie wizualne – implant złożony z 96 mikroelektrod, które są połączone z kamerą ulokowaną w okularach.
Dzięki temu 57-letnia kobieta była w stanie rozpoznać zarys obiektów, rozróżnić gesty prawej i lewej ręki, a nawet grać w gry wideo podobne do labiryntu. Urządzenie wynalazł dr Richard A. Normann John A. Moran Eye Center at the University of Utah, a eksperyment pomogli mu przeprowadzić koledzy ze Spain’s Miguel Hernandez University.
Niestety w implancie Berny było zbyt mało elektrod, aby mogła ona rozpoznawać przedmioty i odzyskać wystarczającą ostrość wzroku do swobodnego codziennego życia. Dlatego teraz uczeni chcą zmniejszyć rozmiar elektrod, tak by dało się zmieścić ich, jak najwięcej w kolejnym implancie7.
Im więcej elektrod, tym wyższa rozdzielczość wizualna. Aby móc rozpoznać twarz lub zarysy obiektów, tak by poruszać się swobodnie, powiedzmy, w obcym pokoju, osoba niewidoma musiałaby mieć 1 000-2000 elektrod podłączonych do kory wizualnej.
Normalna wizja ma rozdzielczość 1 mln pikseli – tłumaczy prof. Shih-Chii Liu z Uniwersytetu Zuryskiego w Szwajcarii. Koordynuje ona projekt NeuraViPeR finansowany przez Unię Europejską, opracowujący elektrody o wysokiej wydajności, które są ok. 4-krotnie cieńsze niż ludzkie włosy.
Nowe implanty zawierają tysiące elektrod osadzonych w elastycznych paskach. Znacząco zwiększy to rozdzielczość wzrokową i poprawi bezpieczeństwo zabiegu poprzez zmniejszenie ryzyka blizn lub negatywnej odpowiedzi immunologicznej8. Projekt ma zakończyć się w 2025 r.
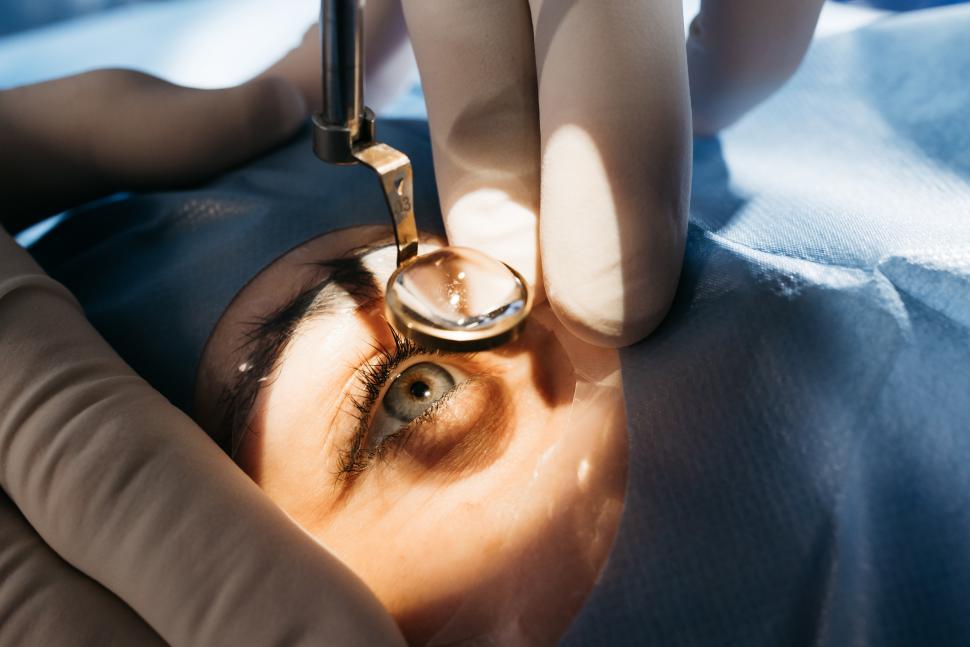
Argus II zawiera małą kamerę wideo, nadajnik zamontowany na okularach, jednostkę przetwarzającą wideo i 60-elektrodową protezę siatkówki, która zastępuje funkcję zdegenerowanych komórek w tej tkance, membranę wyznaczającą wnętrze oka.
Chociaż nie w pełni przywraca widzenie, ta konfiguracja może poprawić zdolność pacjenta do postrzegania obrazów i ruchu, wykorzystując jednostkę przetwarzania wideo do przekształcania obrazów z kamery w dane elektroniczne, które są przesyłane do protezy siatkówki. Kamera przekazuje obraz do procesora noszonego na pasku. Stamtąd biegnie on bezprzewodowo do umieszczonego w głowie implantu, który rzutuje obraz na siatkówkę.
Zespołowi Humayuna udało się częściowo przywrócić wzrok 6 ociemniałym.
Opierając się na symulacjach, zakładaliśmy, że 16-pikselowa kamera pozwoli jedynie na rozróżnienie jasności od ciemności i, być może, niektórych odcieni szarości. Całkowicie się myliliśmy – mówi Mark Humayun z Doheny Eye Institute na University of Southern California. Badacze nieustannie pracują nad zwiększeniem rozdzielczości oraz takim zmniejszeniem implantu, by można go było wszczepić w powiekę. Dzięki temu czas potrzebny do założenia całego systemu uległby skróceniu z 8 godz. do 90 min, a koszt operacji spadłby do ok. 87 tys. złotych.
Uczeni przypuszczają, że aby niewidomy mógł całkowicie odzyskać wzrok, potrzebna jest rozdzielczość ok. 10 000 pikseli. Poza tym proteza pomaga osobom, które niegdyś widziały i mają nienaruszone nerwy wzrokowe9.
Argus II nie jest jedynym opracowywanym implantem siatkówki. Inne rozwiązanie polega na wykonaniu protezy pod częścią siatkówki. Implant AG to 3-milimetrowy układ mikroelektroniczny chip (o grubości 0,1 mm) zawierający ok. 1500 fotodiod wrażliwych na światło, z kolei wzmacniacze i elektrody zostają chirurgicznie umiejscowione poniżej centralnej części siatkówki (tzw. dołku środkowego plamki żółtej, w którym gęstość czopków jest największa, co stwarza najlepsze warunki do analizy obrazu). Ta część siatkówki umożliwia przejrzystość wizji, która jest niezbędna do czytania, oglądania i jazdy.
Chip pomaga generować przynajmniej częściowe widzenie poprzez stymulowanie nienaruszonych komórek nerwowych w siatkówce. Impulsy nerwowe z tych komórek są następnie prowadzone przez nerw wzrokowy do kory wzrokowej. Źródło zasilania układu jest ustawione pod skórą za uchem i podłączone cienkim kablem.
Takie rozwiązanie nie wymaga noszenia okularów. W maju 2012 r. firma ogłosiła, że chirurdzy wszczepili je z powodzeniem 36 pacjentom w 2 badaniach klinicznych10. Natomiast na Uniwersytecie Stanforda po latach prac nad wszczepialną protezą siatkówki, osiągnięto kolejny sukces w terapii zwyrodnienia plamki żółtej (AMD).
Nasz implant zapewnił nie tylko najwyższą rozdzielczość, ale także ukształtował wizję, a nie tylko wrażliwość na światło – wyjaśnia Daniel Palanker, profesor okulistyki i jeden z autorów pracy opublikowanej w listopadzie 2022 r. w Nature Communications11.
Urządzenie zostało zaprojektowane w celu przywrócenia utraty widzenia z powodu zwyrodnienia plamki związanej z wiekiem, która uszkadza siatkówkę, powodując niewyraźne widzenie środkowe.
Po pomyślnym przetestowaniu implantu u szczurów naukowcy optymalizują teraz urządzenie do badań klinicznych.4 lata temu Palanker i jego zespół pokazali, że dzięki cienkim chipom, w których każdy piksel jest wyposażony w fotodiody krzemu i specjalnie zaprojektowanym okularom mogą przywrócić ograniczoną widzenie w centrum pola widzenia osób cierpiących na zwyrodnienie plamki żółtej.
Gdy komórki fotoreceptorów ulegają zniszczeniu, mózg nie otrzymuje już informacji potrzebnych do stworzenia szczegółowego i spójnego obrazu. Obecne leczenie zwyrodnienia plamki żółtej – takie jak witaminy i leki ukierunkowane na naczynia krwionośne, które atakują plamkę i blokują widzenie – mogą tylko spowolnić postęp choroby, ale nie są w stanie przywrócić wzroku.
Ponad 2 dekady temu Daniel Palanker wpadł na pomysł stworzenia protezy siatkówki, która mogłaby zastąpić komórki fotoreceptorów i przejąć ich rolę przekaźnika światła, o ile komórki nerwowe, z którymi komunikują się fotoreceptory, były nienaruszone. Wewnętrzne neurony siatkówki można zniszczyć przez inne zaburzenia wzrokowe, np. jaskrę.
Cieniuteńki chip, który może przekształcić światło na prądy elektryczne, jest wszczepiany w tył oka. Wysyła sygnały elektryczne przez sieć nerwową siatkówki do mózgu, przywracając postrzeganie w środku pola widzenia. Badacze opracowali też okulary wyposażone w kamerę wideo, która przesyła obrazy do fotodiod w chipie z wykorzystaniem bliskiej podczerwieni.
Utracone w wyniku AMD fotoreceptory zastępujemy fotowoltaicznymi pikselami – tłumaczy Palanker. – A aktywujemy je za pomocą niewidzialnego światła rzutowanego z okularów.
Po szeroko zakrojonych badaniach przedklinicznych współpracownicy Palankera we Francji rekrutowali 5 pacjentów z ponad 60, którzy mieli zaawansowaną postać zwyrodnienia plamki żółtej. Ich własne fotoreceptory w jej centralnej części uległy zniszczeniu na skutek choroby, jednak zachowali wewnętrzne komórki nerwowe siatkówki, które mogłyby otrzymać sygnały z implantu.
Chirurdzy oddzielili siatkówkę nad plamką ślepą (to obszar siatkówki oka, w którym nerw wzrokowy opuszcza gałkę oczną; jest całkowicie pozbawiony fotoreceptorów a przez to niewrażliwy na światło) i wsunęli chip pod spód i ponownie nałożyli siatkówkę.
Procedura trwała ok. 2 godz. Kilka miesięcy po operacji uczeni stwierdzili, że za pomocą implantu pacjenci byli w stanie wyczuć światło oraz zobaczyć wzorce rzutowane z kamery na siatkówki, takie jak linie i litery.
Co więcej, u pacjentów biorących udział w badaniu doszło do zintegrowania obrazu z tymi częściami oka, na które choroba nie miała wpływu, dzięki czemu mogli zobaczyć spójny obraz12.

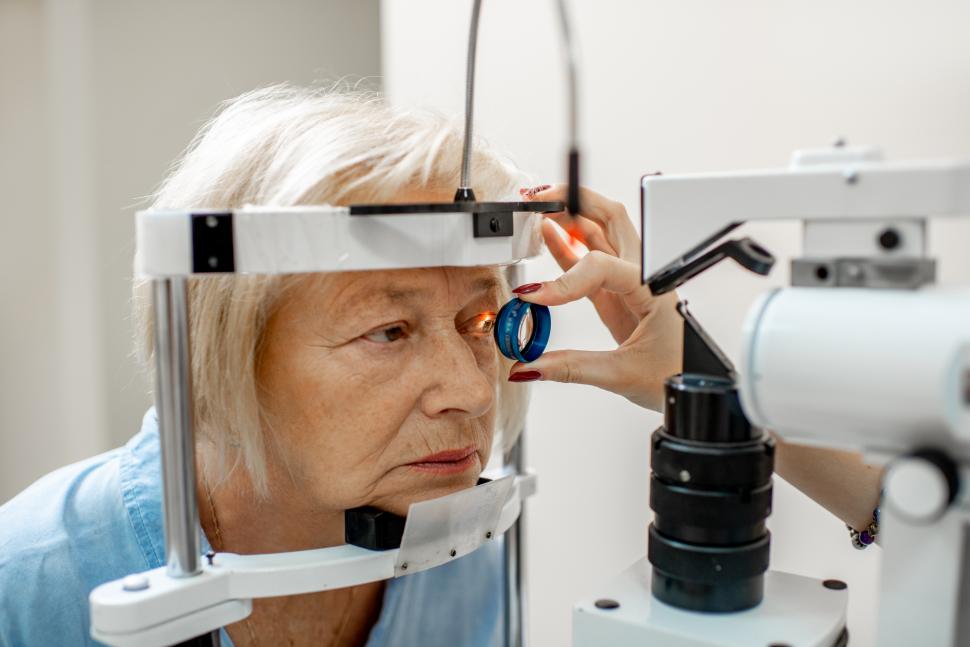
Jak chronić wzrok?
Według raportu „Lancet Global Health”, który zgromadził dane ze 188 krajów, obecnie 200 mln ludzi ma różnego rodzaju uszkodzenia wzroku, a do 2050 r. ich liczba zwiększy się do 550 mln. Nawet umiarkowane zakłócenia wzroku grożą pogorszeniem jakości życia, natomiast ślepota sprawia, że w mniejszym lub większym stopniu jesteśmy zdani na pomoc innych – zwraca uwagę prof. Rupert Bourne z Anglia Ruskin University, będący jednym z autorów raportu.
Najczęściej spotykanymi chorobami, które mogą prowadzić do ślepoty, są zaćma, jaskra i zwyrodnienie plamki żółtej związane z wiekiem (AMD). Utratę wzroku może również spowodować zakażenie oka wirusem opryszczki, a także w niektórych – na szczęście bardzo rzadkich przypadkach – zespół suchego oka.
Oczywiście lepiej zapobiegać niż leczyć, zwłaszcza że choć osiągnięcia naukowców są spektakularne, to jednak wynalezionym przez nich rozwiązaniom wciąż daleko do doskonałości naszych własnych oczu.
Jednym z najprostszych środków zapobiegawczych są regularne badania okulistyczne, które osoby po 40. r.ż. powinny wykonywać co 2 lata. Dzięki temu możliwe będzie wczesne wykrycie i leczenie zaćmy, AMD oraz jaskry. W tym ostatnim przypadku, jeśli dorosły jest w grupie wysokiego ryzyka zachorowania, to badania okulistyczne powinien wykonywać raz w roku lub częściej, w zależności od zaleceń lekarza prowadzącego.

Dlatego warto wspomagać zdrowie oczu dietą oraz suplementami. Jedną z przyczyn zaburzeń widzenia mogą być niedobory luteiny i zeaksantyny. Związki te odgrywają istotną rolę w zachowaniu struktury i funkcji siatkówki. Japończycy odkryli, że przyjmowanie 5 mg luteiny i 1 mg zeaksantyny dziennie ogranicza pojawianie się tzw. efektu zmęczonych oczu po długotrwałym wpatrywaniu się w ekran komputera13.
Dowiedziono, że regularne przyjmowanie 6 mg luteiny dziennie zmniejszyło o 57% ryzyko wystąpienia AMD14. Co więcej, suplementacja tym ksantofilem przez 18 miesięcy (15 mg dziennie) u osób już zmagających się z chorobą skutkowała istotną poprawą ostrości widzenia15. Podobne wyniki osiągnięto w przypadku zaćmy. Co ważne u pacjentów już dotkniętych tym schorzeniem, u których suplementowano 15 mg luteiny i 100 mg witaminy E dziennie przez okres 2 lat, odnotowano znaczną poprawę jakości widzenia i wrażliwości oka na światło w porównaniu do pacjentów przyjmujących jedynie witaminę E16. Ponadto u osób przyjmujących oba związków odnotowano zwiększoną gęstość optyczną pigmentu plamki żółtej17.
Nie zapominaj też o dobroczynnej dla rogówki witaminie A. Jej niedobór może przyczyniać się do rozwoju zespołu suchego oka. Zbyt niskie stężenie tego składnika w pręcikach może skutkować kurzą ślepotą. Szczęśliwie stan ten można odwrócić po zwiększonym spożyciu lub suplementacji witaminą A18. Co więcej, może ona także sprzyjać regeneracji komórek spojówki i przywracać wewnątrzkomórkowe połączenia jej nabłonka, zapobiegając uszkodzeniom spowodowanym przez leki przeciwko jaskrze19.

Z kolei witamina C chroni m.in. przed dymem tytoniowym, na który narażone są oczy. Jest też niezbędna do wytwarzania kolagenu – białka, które zapewnia oku strukturę, szczególnie w rogówce i twardówce20. Wyniki kilku badań sugerują, że zmniejsza przy tym ryzyko rozwoju zaćmy: obniża je aż o 75%, kiedy dzienne spożycie przekracza 490 mg21.
W jadłospisie nie powinno też zabraknąć produktów bogatych w kwasy omega-3 lub ich suplementów. Ułatwiają one przyswajanie luteiny i zeaksantyny22. Co istotne kwasy EPA i DHA obniżają ciśnienie śródgałkowe, zwiększają przepływ krwi w oku i poprawiają funkcję neuroprotekcyjną w zakresie wzroku, chroniąc tym samym przed jaskrą23. Ponadto zapobiegają wysychaniu oczu podczas pracy przy komputerze oraz zmniejszają ryzyko makulopatii związanej z wiekiem (ARM)24.
W jednym z chińskich badań u 120 pacjentów w średnim wieku, u których zdiagnozowano łagodną do umiarkowanej postaci zespołu suchego oka i podawano doustnie, 2 razy dziennie tabletki zawierające 6 mg astaksantyny złagodziła ona objawy choroby. Eksperyment trwał 30 dni. Pomiary i ocenę stanu oczu przeprowadzano po 2 tygodniach i na koniec badania26.
Jeżeli cierpisz z powodu tej przypadłości, stosuj do nawilżania gałki ocznej krople z kwasem hialuronowym. Metaanaliza 19 badań obejmująca 2 078 przypadków przeprowadzona przez Koreańczyków w celu porównania skuteczności kropli do oczu w leczeniu zespołu suchego oka pokazała, że te zawierające kwas hialuronowy znacznie poprawiały produkcję filmu łzowego w porównaniu do tych bez niego (w tym soli fizjologicznej i konwencjonalnych sztucznych łez)27.
Potwierdzają to również wyniki innego przeglądu 53 badań klinicznych. Jego autorzy zauważyli, że terapeutyczne stężenia kwasu hialuronowego wahają się od 0,1% do 0,4%, a także, że w żadnej z analizowanych prac „nie zgłoszono poważnych powikłań ani zdarzeń niepożądanych”28.
- Przegląd Okulistyczny. 29 (2), s. 1,3, 2009
- Jürgen Thorwald - Triumf chirurgów. W rodz.: Okno na świat. Wydawnictwo Literackie, Kraków 1988, s. 191-205; Clin Exp Ophthalmol. 2005 Dec;33(6):642-57
- Nat Biotechnol. 2023 Jan;41(1):70-81
- Nature. 2020 Dec;588(7836):124-29, doi:10.1038/s41586-020-2975-4
- PNAS U S A. 2023 May 9;120(19):e2122168120
- Nat Commun. 2020 Nov 5;11(1):5614
- J Clin Invest. 2021;131(23):e151331. doi: 10.1172/JCI151331
- https://cordis.europa.eu/project/id/899287, doi: 10.3030/899287
- Vision Res. 2001;41(10-11):1261-75; Ophthalmology. 2012 Apr;119(4):779-88; Prog Retin Eye Res. 2016 Jan:50:89-107
- Nature (2013). doi: 10.1038/nature.2013.12439; Br J Ophthalmol. 2014 Jul;98(7):852-6
- J Neural Eng. 2005 Mar;2(1):S105-20; Rep Prog Phys. 2016 Sep;79(9):096701; Nat Commun 13, 513 (2022), doi: 10.1038/s41467-022-28125-x
- Ophthalmology 2020;127:1097-104, doi: 10.1016/j.ophtha.2020.02.02; Cold Spring Harb Perspect Med. 2023 Aug 1;13(8):a041525
- Appl Ergon. 2009 Nov; 40(6):1047-54. Epub 2009 Jun 21
- JAMA 1994; 272(18):1413-20
- Assoc Res Vision Opthalmol 2001; 42:S234
- Nutrition 2003 Jan;19(1):21-4
- JAMA Ophthalmol. 2013; 131:843-50; Ophthalmol Sci. 2021; 1:100039; Invest Ophthalmol Vis Sci. 2014; 55:5238-44
- Am J Clin Nutr. 2011; 94(2):658S-65S
- Chin J Ophthalmol. 2010; 46(2):151-60
- Micron. 2001 Apr;32(3):261-72
- Am J Clin Nutr. 1991 Jan; 53(1 Suppl):352S-5S
- Am J Clin Nutr. 2008 May; 87(5):1521-9
- Int J Ophthalmol. 2011; 4(6):64865
- Ophthalmology 2013; 120(11):2191-6; Invest Ophthalmol Vis Sci. 2011; 52(8):6004-11
- Mar Drugs. 2020 May; 18(5): 23
- Front Nutr. 2022 Jan 13:8:796951
- Int J Environ Res Public Health. 2021 Mar; 18(5): 238
- Acta Ophthalmol. 2022 Dec; 100(8): 844-60

 Nasze magazyny
Nasze magazyny